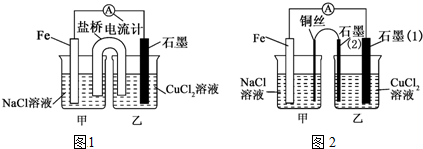
题目内容
14.常温下,某酸HA的电离常数:K=1×10-5,下列说法正确的是( )| A. | HA溶液中加入NaA固体后,$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$减小 | |
| B. | 常温下,0.1mol/LHA溶液中水电离的c(H+)为10-13mol/L | |
| C. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-) | |
| D. | 常温下,0.1mol/LNaA溶液水解常数为10-9 |
分析 A.$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$的比值为A-的水解平衡常数,水解平衡常数只受温度影响;
B.HA为弱酸,则氢离子浓度小于0.1mol/L,水电离的氢离子浓度大于10-13mol/L;
C.根据混合液中的物料守恒判断;
D.NaA的水解平衡常数K=$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$=$\frac{{K}_{w}}{K(HA)}$,据此带入数据计算即可.
解答 解:A.$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$的比值为A-的水解平衡常数,加入NaA固体后,由于温度不变,则水解平衡常数不变,故A错误;
B.由于HA为弱酸,则常温下0.1mol/LHA溶液中氢离子浓度小于0.1mol/L,水电离的c(H+)一定大于$\frac{1×1{0}^{-14}}{0.1}$mol/L=10-13mol/L,故B错误;
C.NaA溶液中加入HCl溶液至恰好完全反应,NaA和HCl的物质的量相等,根据物料守恒可得:2c(Na+)=c(A-)+c(Cl-)+c(HA),故C错误;
D.NaA的水解平衡常数K=$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$=$\frac{{K}_{w}}{K(HA)}$=$\frac{1×1{0}^{-14}}{1×1{0}^{-5}}$=10-9,故D正确;
故选D.
点评 本题考查了离子浓度大小比较、盐的水解原理、弱电解质的电离平衡等知识,题目难度中等,明确影响弱电解质的电离平衡、盐的水解原理的因素为解答关键,注意掌握电荷守恒、物料守恒在判断离子浓度大小中的应用方法.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
4.向含2mol NaOH、1mol Ba(OH)2、2mol NaAlO2的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是( )
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 2 | 2 | 3 | 3 |
| A. | A | B. | B | C. | C | D. | D |
5.下列离子方程式正确的是( )
| A. | 氢氧化钠溶液中通入足量二氧化硫:SO2+2OH-═SO32-+H2O | |
| B. | 石灰水与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 钠与水反应:Na+2H2O═2OH-+Na++H2↑ | |
| D. | 向少量碳酸氢钠溶液中滴加足量澄清石灰水:HCO${\;}_{3}^{-}$+Ca2++OH-═CaCO3↓+H2O |
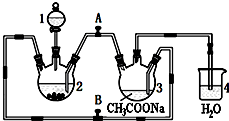 醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如右图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如右图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
 .
.