题目内容
9.某学生用已知物质的量浓度的盐酸来测定未知浓度的氢氧化钠溶液时,选择甲基橙作指示剂,下列操作中可能使所测氢氧化钠溶液浓度偏大的是( )| A. | 酸式滴定管未用标准盐酸润洗,直接装入标准盐酸 | |
| B. | 酸式滴定管滴定前有气泡,滴定后气泡消失 | |
| C. | 滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥 | |
| D. | 读取醋酸体积时,开始仰视读数,滴定结束后俯视读数 |
分析 根据中和滴定不当操作对物质的量浓度c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$的影响分析产生的误差,据此进行解答.
解答 解:A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液被稀释,浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$可知,测定c(NaOH)偏大,故A正确;
B.酸式滴定管尖嘴处在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$可知测定的c(NaOH)偏大,故B正确;
C.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$可知测定的c(NaOH)无影响,故C错误;
D.读取盐酸体积时,滴定开始时仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$可知,测定的c(NaOH)偏低,故D错误;
故选AB.
点评 本题考查了中和滴定操作方法及误差分析,题目难度中等,明确中和滴定方法为解答关键,注意根据中和滴定不当操作对c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$的影响分析误差,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.与“实验操作”相对应的“实验现象”的字母代号填入答案栏中
| 实验操作 | 答案 | 实验现象 |
| (1)将浓硫酸滴在小木条上 | A.产生白烟 | |
| (2)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近 | B.溶液褪色 | |
| (3)在盛有KI淀粉溶液的试管中滴加氯水 | C.溶液呈红色 | |
| (4)在盛有FeCl3溶液的试管中滴入2滴KSCN溶液 | D.产生棕红色气体 | |
| (5)铜丝放到浓硝酸中 | E.变黑色 | |
| (6)铜丝放入热的浓硫酸溶液中,将生成气体通入品红溶液中 | F.产生蓝色物质 |
7.下列说法正确的是( )
| A. | 淀粉遇到KI溶液呈现特殊蓝色 | |
| B. | 淀粉和纤维素属于多糖,其分子式均为(C6H10O5)n,二者互为同分异构体 | |
| C. | 多糖一般不溶于水,没有甜味,没有还原性 | |
| D. | 在稀硫酸作用下,淀粉水解生成葡萄糖和果糖 |
14.在一密闭容器中加入A、B两种气体,保持一定温度,在t1、t2、t3、t4时刻测得各物质的浓度如下:
据此判断下列结论中正确的是( )
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/mol•L-1 | 6 | 3 | 2 | 2 |
| c(B)/mol•L-1 | 5 | 3.5 | 3 | 3 |
| c(C)/mol•L-1 | 1 | 2.5 | 3 | 3 |
| A. | 在容器中发生的反应为2A+B?2C | |
| B. | 该温度下,此反应的平衡常数为0.25 | |
| C. | A的平衡转化率比B的平衡转化率低 | |
| D. | 起始加入的A、B物质的量相等 |
18.氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图.
①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ/mol
②4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ/mol
下列说法中不正确的是( )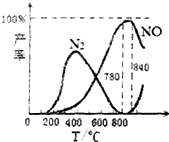
①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ/mol
②4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ/mol
下列说法中不正确的是( )

| A. | N2(g)+O2(g)?2NO(g)△H=+181.5kJ/mol | |
| B. | NH3的燃烧热为226.25kJ/mol | |
| C. | 工业上氨催化氧化生成NO时,温度应控制在780~840℃之间 | |
| D. | 用铂丝做催化剂,利用反应①来制备硝酸 |


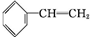 +Br2→
+Br2→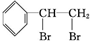 ,反应类型是加成反应.
,反应类型是加成反应.