题目内容
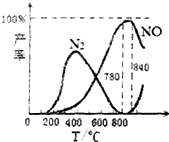
18.氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图.①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ/mol
②4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ/mol
下列说法中不正确的是( )
| A. | N2(g)+O2(g)?2NO(g)△H=+181.5kJ/mol | |
| B. | NH3的燃烧热为226.25kJ/mol | |
| C. | 工业上氨催化氧化生成NO时,温度应控制在780~840℃之间 | |
| D. | 用铂丝做催化剂,利用反应①来制备硝酸 |
分析 A.利用盖斯定律书写热化学方程式;
B.燃烧热为1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
C.从转化率的大小与温度的关系选择反应的适宜温度;
D.用铂丝做催化剂,利用反应①来先制备NO,再制备硝酸.
解答 解:A.根据盖斯定律,$\frac{1}{2}$(①-②)得N2(g)+O2(g)?2NO(g)△H=$\frac{1}{2}$[-905kJ/mol-(-1268kJ/mol)]=+181.5kJ/mol,故A正确;
B.燃烧热为1mol可燃物完全燃烧生成稳定氧化物时放出的热量,根据给定的方程式得不到氨气燃烧热的热方程式,不能计算,故B错误;
C.从图象可以看在,反应温度在在780~840℃之间,NO的产率最大,故C正确;
D.用铂丝做催化剂,根据反应和图象,升高温度,NO的产率较高,利用反应①来先制备NO,再制备硝酸,故D正确;
故选B.
点评 本题考查化学平衡影响元素、反应热的计算等问题,难度不大,注意对题中图象的分析控制不同的温度获得不同的主要产物.

练习册系列答案
相关题目
18.下列说法或表示方法中正确的是( )
| A. | 氢气的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式为2H2(g)+02(g)=2H20(1)△H=-285kJ•mol-1 | |
| B. | 等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多 | |
| C. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应转移电子的数小于0.6×6.02×1023 | |
| D. | 已知中和热为57.3kJ•mol-1,若将含0.5molH2S04的浓硫酸溶液与含1mol Na0H的溶液混合,放出的热量要小于57.3kJ |
9.某学生用已知物质的量浓度的盐酸来测定未知浓度的氢氧化钠溶液时,选择甲基橙作指示剂,下列操作中可能使所测氢氧化钠溶液浓度偏大的是( )
| A. | 酸式滴定管未用标准盐酸润洗,直接装入标准盐酸 | |
| B. | 酸式滴定管滴定前有气泡,滴定后气泡消失 | |
| C. | 滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥 | |
| D. | 读取醋酸体积时,开始仰视读数,滴定结束后俯视读数 |
3.下列分子属于手性分子的是( )
| A. | CCl2F2 | B. |  | C. | CH3CH2OH | D. |  |
10.短周期主族元素X、Y、Z、W、Q的原子序数依次增大.X的气态氢化物极易溶于Y的氢化物中.常温下,Z的块状单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| A. | 元素Y的最高正化合价+6 | |
| B. | 简单离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 气态氢化物的稳定性:Q>W | |
| D. | 元素W的最高价氧化物对应的水化物酸性比Q的强 |
8.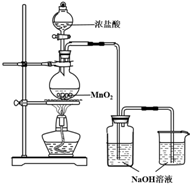 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.
(1)写出装有浓盐酸的仪器名称分液漏斗,A中烧瓶内进行的反应中浓盐酸体现出的化学性质是酸性和还原性
(2)写出装置B中发生的所有反应化学方程式Cl2+2NaOH=NaCl+NaClO+H2O、HCl+NaOH=NaCl+H2O
(3)装置c的作用是吸收多余氯气,避免污染空气
反应停止后,各取洗气瓶中无色溶液5mL分别进行了如下实验:
(4)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去
为探究操作A中溶液褪色的原因,又补充了如下实验:
获得结论:此实验小组制备的消毒液具有漂白性.
(5)操作B中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.(1)写出装有浓盐酸的仪器名称分液漏斗,A中烧瓶内进行的反应中浓盐酸体现出的化学性质是酸性和还原性
(2)写出装置B中发生的所有反应化学方程式Cl2+2NaOH=NaCl+NaClO+H2O、HCl+NaOH=NaCl+H2O
(3)装置c的作用是吸收多余氯气,避免污染空气
反应停止后,各取洗气瓶中无色溶液5mL分别进行了如下实验:
| 操作 | 现象 |
| A.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| B. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
为探究操作A中溶液褪色的原因,又补充了如下实验:
| 操作 | 现象 |
| 取5ml,pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
(5)操作B中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).

 Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.
Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.