题目内容
14.在一密闭容器中加入A、B两种气体,保持一定温度,在t1、t2、t3、t4时刻测得各物质的浓度如下:| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/mol•L-1 | 6 | 3 | 2 | 2 |
| c(B)/mol•L-1 | 5 | 3.5 | 3 | 3 |
| c(C)/mol•L-1 | 1 | 2.5 | 3 | 3 |
| A. | 在容器中发生的反应为2A+B?2C | |
| B. | 该温度下,此反应的平衡常数为0.25 | |
| C. | A的平衡转化率比B的平衡转化率低 | |
| D. | 起始加入的A、B物质的量相等 |
分析 A.t1到t2,A、B分别消耗了3mol/L、1.5mol/L,同时生成了1.5mol/L的C,根据浓度变化与化学计量数成正比可得出反应方程式;
B.t3达到平衡状态,结合平衡浓度计算平衡常数;
C.t1到t2,A、B分别消耗了3mol/L、1.5mol/L,同时生成了1.5mol/L的C,反应关系为:2A+B?C,极值转化反应前A的浓度为8mol/L、B为6mol/L;
D.根据选项C可知起始加入A、B的物质的量.
解答 解:A.t1到t2时间段A、B分别消耗了3mol/L、1.5mol/L,同时生成了1.5mol/L的C,则该反应方程式为:2A(g)+B(g)?C(g),故A错误;
B.反应方程式为2A(g)+B(g)?C(g),则该反应的平衡常数为:$\frac{3}{3×{2}^{2}}$=0.25,故B正确;
C.t1到t2,A、B分别消耗了3mol/L、1.5mol/L,同时生成了1.5mol/L的C,反应关系为:2A(g)+B(g)?C(g),极值转化反应前A的浓度为8mol/L、B为6mol/L,A的转化率为$\frac{3}{8}$×100%=37.5%,B的转化率为:$\frac{1.5}{6}$×100%=25%,A的转化率大于B的转化率,故C错误;
D.根据C可知,反应前A的浓度为8mol/L、B为6mol/L,A、B的浓度不相等,故D错误;
故选B.
点评 本题考查了化学平衡的计算,题目难度中等,根据表中数据正确书写反应方程式为解答关键,注意掌握化学反应速率、转化率、化学平衡常数的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
14.目前使用最多的气体石化燃料是( )
| A. | 煤 | B. | 石油 | C. | 天然气 | D. | CO |
15.以下比较镁、铝金属性强弱的实验方案不合理的是( )
| A. | 镁、铝分别与热水反应 | |
| B. | 镁、铝分别与盐酸反应 | |
| C. | 氯化镁溶液、氯化铝溶液分别与氢氧化钠溶液反应 | |
| D. | 将镁-铝-氢氧化钠溶液设计为原电池 |
2.A、B是元素周期表中同周期的两种主族元素,它们可以形成离子化合物AmBn,且离子均达到稀有气体原子的电子层结构.若A的原子序数为a,则B的原子序数可能是( )
| A. | a+8+m-n | B. | a+18-m+n | C. | a+32-m-n | D. | a+24-m-n |
9.某学生用已知物质的量浓度的盐酸来测定未知浓度的氢氧化钠溶液时,选择甲基橙作指示剂,下列操作中可能使所测氢氧化钠溶液浓度偏大的是( )
| A. | 酸式滴定管未用标准盐酸润洗,直接装入标准盐酸 | |
| B. | 酸式滴定管滴定前有气泡,滴定后气泡消失 | |
| C. | 滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥 | |
| D. | 读取醋酸体积时,开始仰视读数,滴定结束后俯视读数 |
19.下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题.
(1)地壳中含量最多的元素是O;
(2)N和O中,原子半径较小的是O;
(3)单质的化学性质最不活泼的是Ar;
(4)S原子结构示意图是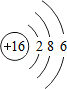 ;
;
(5)HF和HCl中,热稳定性较强的是HF;
(6)SiO2常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(7)元素最高价氧化物对应的水化物中,具有两性的是Al2O3(填化学式),碱性最强的是NaOH(填化学式);
(8)新制氯水有漂白作用,是因为其中含有HClO(填“HCl”或“HCIO”);
(9)碳元素的最高价氧化物的化学式是CO2,其碳元素与氧元素的物质的量比n(C):n(O)=1:2.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | Si | S | Cl | Ar |
(2)N和O中,原子半径较小的是O;
(3)单质的化学性质最不活泼的是Ar;
(4)S原子结构示意图是
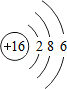 ;
;(5)HF和HCl中,热稳定性较强的是HF;
(6)SiO2常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(7)元素最高价氧化物对应的水化物中,具有两性的是Al2O3(填化学式),碱性最强的是NaOH(填化学式);
(8)新制氯水有漂白作用,是因为其中含有HClO(填“HCl”或“HCIO”);
(9)碳元素的最高价氧化物的化学式是CO2,其碳元素与氧元素的物质的量比n(C):n(O)=1:2.
3.下列分子属于手性分子的是( )
| A. | CCl2F2 | B. |  | C. | CH3CH2OH | D. |  |
4.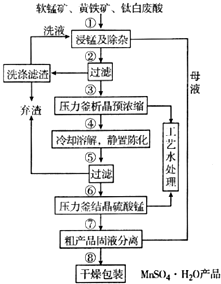 随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:
随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:
(1)实验室在过滤操作过程中,使用的玻璃仪器名称为烧杯、玻璃棒、漏斗.
(2)“浸锰”反应中往往有副产物MnS2O6的生成.温度对“浸锰”反应的影响如图1、图2所示,为减少MnS2O6的生成,“浸锰”的适宜温度为150℃(或150℃以上). (3)经查阅资料,生成相应氢氧化物时的pH如表所示.
(3)经查阅资料,生成相应氢氧化物时的pH如表所示.
实际生产过程中,①中加入一定量纯MnO2粉末的主要作用是将Fe2+氧化为Fe3+,将过量的SO2氧化除去;②中调节pH为3.5时,沉淀的主要成分是Fe(OH)3.
(4)⑤中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4.用平衡移动原理解释加入MnS的作用:MnS存在沉淀溶解平衡,MnS(S)?Mn2+(aq)+S2-(aq),加入后铜离子和硫离子结合市场难溶的硫化铜沉淀,S2-(aq)+Cu2+(aq)?CuS(S)生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去.
(5)检验⑥中沉淀是否洗涤干净的方法是取少量最后一次洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净;反之则未洗干净.
 随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:
随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:(1)实验室在过滤操作过程中,使用的玻璃仪器名称为烧杯、玻璃棒、漏斗.
(2)“浸锰”反应中往往有副产物MnS2O6的生成.温度对“浸锰”反应的影响如图1、图2所示,为减少MnS2O6的生成,“浸锰”的适宜温度为150℃(或150℃以上).
 (3)经查阅资料,生成相应氢氧化物时的pH如表所示.
(3)经查阅资料,生成相应氢氧化物时的pH如表所示.| 化学式 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(4)⑤中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4.用平衡移动原理解释加入MnS的作用:MnS存在沉淀溶解平衡,MnS(S)?Mn2+(aq)+S2-(aq),加入后铜离子和硫离子结合市场难溶的硫化铜沉淀,S2-(aq)+Cu2+(aq)?CuS(S)生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去.
(5)检验⑥中沉淀是否洗涤干净的方法是取少量最后一次洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净;反之则未洗干净.