题目内容
10.燃烧法是测定有机化合物化学式的一种重要方法,300℃时完全燃烧0.1mol某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重9.0g,乙装置增重22.0g,回答下列问题:
(1)该烃的分子式为C5H10.
(2)经测定该烃结构中只有一个甲基且可使酸性高锰酸钾溶液褪色,试写出该烃与H2发生反应的化学方程式:CH2=CHCH2CH2CH3+H2$→_{△}^{催化剂}$CH2CH2CH2CH2CH3.
(3)题(2)中的产物有多种同分异构体,其中一氯代物只有一种的结构简式是C(CH3)4;该烃的二氯代物的同分异构体有2种.
分析 (1)0.1molA燃烧可得:n(H2O)=$\frac{9g}{18g/mol}$=0.5mol,n(CO2)=$\frac{22g}{44g/mol}$0.5mol,由原子守恒,故烃A的分子式为C5H10,
(2)经测定该烃结构中只有一个甲基且可使酸性高锰酸钾溶液褪色,则烃的结构简式为CH2=CHCH2CH2CH3;
(3)CH2CH2CH2CH2CH3的同分异构体一氯代物只有一种的结构简式是:C(CH3)4,该烃的二氯代物可以连接同一碳原子上,也可以用在不同碳原子上.
解答 解:(1)n(H2O)=$\frac{9g}{18g/mol}$=0.5mol,n(CO2)=$\frac{22g}{44g/mol}$0.5mol,所以烃分子中C原子数目为$\frac{0.5mol}{0.1mol}$=5,H原子数目为$\frac{0.5mol×2}{0.1mol}$=10,故烃A的分子式为C5H10,
故答案为:C5H10;
(2)经测定该烃结构中只有一个甲基且可使酸性高锰酸钾溶液褪色,则烃的结构简式为CH2=CHCH2CH2CH3,该烃与H2发生反应的化学方程式:CH2=CHCH2CH2CH3+H2$→_{△}^{催化剂}$CH2CH2CH2CH2CH3,
故答案为:CH2=CHCH2CH2CH3+H2$→_{△}^{催化剂}$CH2CH2CH2CH2CH3;
(3)CH2CH2CH2CH2CH3的同分异构体一氯代物只有一种的结构简式是:C(CH3)4,该烃的二氯代物可以连接同一碳原子上,也可以用在不同碳原子上,该烃的同分异构体有2种,
故答案为:C(CH3)4;2.
点评 本题考查有机物分子式的确定、限制条件同分异构体的书写,要求学生能够根据质量守恒确定有机物的分子式,掌握烷烃同分异构体书写方法,难度不大.

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案| A. | 标准状况下,2.24 L CO2与一定量的Na2O2反应转移的电子数目一定为0.1NA | |
| B. | C2H2、H2O2、Na2O2的最简式都可以用AB的形式表示 | |
| C. | 50 mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 2.0 gH218O与D216O的混合物中所含中子数为NA |
(1)【提出假设】假设1:所得沉淀为Cu(OH)2;
假设2:所得沉淀为CuCO3;(填化学式)
假设3:所得沉淀为碱式碳酸铜[化学式可表示为mCu(OH)2•nCuCO3].
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水).
【定性探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如装置如图(夹持仪器未画)进行定性实验;
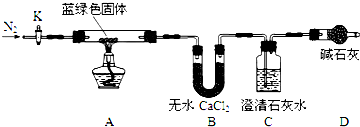
(2)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设1成立.
(3)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是B(填代号).
A.浓硫酸 B.无水CuSO4 C.碱石灰 D.P2O5
(4)乙同学验证假设3成立的实验现象是A中蓝绿色固体变黑色,B中无水CuSO4固体变蓝,C中有白色沉淀产生.
【定量探究】
(5)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在常温时的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是AC(填代号).
| 溶解度(S)/p | 溶度积(Ksp) | 摩尔质量(M)/g•mol-1 | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
B.Ba(OH)2为强碱,Ca(OH)2为弱碱
C.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
D.相同条件下,CaCO3的溶解度明显大于BaCO3
②若所取蓝绿色固体质量为27.1g,实验结束后,装置B的质量增加2.7g,C中产生沉淀的质量为19.7g.则该蓝绿色固体的化学式为2CuCO3•3Cu(OH)2、或3Cu(OH)2•2CuCO3或Cu5(OH)6(CO3)2;A中发生反应的化学方程式为2CuCO3•3Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$5CuO+3H2O↑+2CO2↑.
| A. | 氢气的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式为2H2(g)+02(g)=2H20(1)△H=-285kJ•mol-1 | |
| B. | 等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多 | |
| C. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应转移电子的数小于0.6×6.02×1023 | |
| D. | 已知中和热为57.3kJ•mol-1,若将含0.5molH2S04的浓硫酸溶液与含1mol Na0H的溶液混合,放出的热量要小于57.3kJ |
| A. | 原子半径大小顺序:W>Z>Y>X | |
| B. | Z在周期表中的位置是第三周期第IA族 | |
| C. | X的气态氢化物的还原性比W的弱 | |
| D. | W比Y更容易与氢气反应 |
| A. | 镁、铝分别与热水反应 | |
| B. | 镁、铝分别与盐酸反应 | |
| C. | 氯化镁溶液、氯化铝溶液分别与氢氧化钠溶液反应 | |
| D. | 将镁-铝-氢氧化钠溶液设计为原电池 |
| A. | 乙醇分子中有1个氢原子与其他氢原子不一样 | |
| B. | 乙醇分子可认为是由乙烷分子中的一个-H被一个-OH取代产生的 | |
| C. | 乙醇分子中的每个碳原子都形成了四个共价键,但显示化合价不是+4价 | |
| D. | 乙醇的相对分子质量为46,相对分子质量为46的有机物就是乙醇 |
| A. | 酸式滴定管未用标准盐酸润洗,直接装入标准盐酸 | |
| B. | 酸式滴定管滴定前有气泡,滴定后气泡消失 | |
| C. | 滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥 | |
| D. | 读取醋酸体积时,开始仰视读数,滴定结束后俯视读数 |
| A. | 元素Y的最高正化合价+6 | |
| B. | 简单离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 气态氢化物的稳定性:Q>W | |
| D. | 元素W的最高价氧化物对应的水化物酸性比Q的强 |