题目内容
4.工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)?2NH3(g),其部分工业流程如图: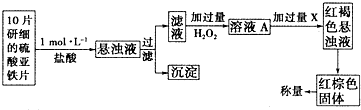
回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905kJ/mol
2H2(g)+O2(g)═2H2(g)△H=-483.6kJ/mol
则N2(g)+2H2?2NH3(g)的△H=-92.4kJ/mol;
(2)如果工业上,在一定温度下,将1.5mol N2气体和6mol H2气体通入到体积为1升的密闭容器中.当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为0.057.改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是①②;
①增大压强②增大反应物质的浓度
③使用催化剂④降低温度
(3)合成氨反应的平衡常数很小,所以在工业采取气体循环的流程.即反应后通过降低混合气体的温度而使氢气分离出来.这种分离物质的方法其原理类似于下列哪种方法:②(填编号)
①过滤 ②蒸馏 ③渗析 ④萃取
理由是通过温度的改变而改变物质的状态,达到分离的目的;
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成.该反应的化学方程式为8NH3+3Cl2=N2+6NH4Cl;
(5)假如该厂生产氨水的物质的量浓度为20mol/L,实验室若需用80mL浓度为5mol/L的氨水时,需取20mol/L的氨水25mL(用100mL的容量瓶).假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH小于14-a(填“大于”“小于”或“等于”).
分析 (1)根据盖斯定律计算,已知:①N2(g)+O2(g)=2NO(g);△H=180.5kJ/mol
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ/mol
③2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
由盖斯定律,①+③×$\frac{3}{2}$-②×$\frac{1}{2}$得;
(2)依据平衡三行计算列式计算平衡浓度,气体压强之比等于气体物质的量之比,平衡常数指生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;平衡常数只受温度影响,平衡常数不变,温度不能变化,结合反应特点,根据外界条件对平衡的影响具体分析判断;
(3)反应后通过降低混合气体的温度而使氢气分离出来是控制温度分离和蒸馏操作原理相似;
(4)氨气和氯气反应生成的白烟是氯化铵的固体;
(5)氨水稀释的前后溶质的量保持不变,氨水是弱电解质,存在电离平衡.
解答 解:(1)已知:①N2(g)+O2(g)=2NO(g);△H=180.5kJ/mol
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ/mol
③2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
由盖斯定律,①+③×$\frac{3}{2}$-②×$\frac{1}{2}$得,N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol.
故答案为:-92.4kJ/mol.
(2)反应达到平衡时,对于反应结合三行计算列式计算,设平衡后消耗氮气物质的量浓度为x,
N2(g)+3H2(g)?2NH3(g)
起始量(mol/L) 1.5 6 0
变化量(mol/L) x 3x 2x
平衡量(mol/L) 1.5-x 6-3x 2x
容器内气体的压强为起始时的80%,(1.5-x+6-3x+2x)=(1.5+6)×80%,
x=0.75mol/L,
氮气、氢气、氨气平衡浓度分别为:1.5mol/L-0.75mol/L=0.75mol/L、6mol/L-3×0.75mol/L=3.75mol/L、1.5mol/L,
所以平衡时平衡常数指生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,所以对于:
N2(g)+3H2(g)?2NH3(g)的反应平衡常数k=$\frac{1.{5}^{2}}{0.75×3.7{5}^{3}}$=0.057.
①反应为气体体积减小的反应,增大压强平衡向气体体积减小方向移动,即向正反应移动,平衡常数不变,故①正确;
②增大反应物的浓度,平衡向正反应移动,平衡常数不变,故②正确;
③使用催化剂,加快反应速率,平衡不移动,故③错误;
④合成氨是放热反应,降低温度,平衡向放热反应方向移动,即向正反应移动,但平衡常数增大,故④错误.
故答案为;0.057;①②;
(3)合成氨反应的平衡常数很小,所以在工业采取气体循环的流程.即反应后通过降低混合气体的温度而使氢气分离出来.通过温度的改变而改变物质的状态,达到分离的目的,这种分离物质的方法其原理类似于下列蒸馏方法,
故答案为:②;通过温度的改变而改变物质的状态,达到分离的目的;
(4)氯气和氨气的反应方程式为:8NH3+3Cl2═N2+6NH4Cl,故答案为:8NH3+3Cl2═N2+6NH4Cl;
(5)根据稀释前后溶质的量保持不变,设需取20mol/L的氨水体积为V,则:20mol/L•V=80mL•5mol/L,解得V=25ml,
氨水的pH=a,则氨水的浓度大于10a-14,所以消耗相同体积的盐酸的浓度大于10a-14,即此盐酸的pH小于14-a,
故答案为:25mL;小于.
点评 本题题目综合性较大,涉及盖斯定律、化学平衡和平衡常数计算、平衡移动的影响因素、溶液稀释和弱电解质电离平衡分析等知识点,考查学生分析和解决问题的能力,题目难度中等.

| A. | 原子半径大小顺序:W>Z>Y>X | |
| B. | Z在周期表中的位置是第三周期第IA族 | |
| C. | X的气态氢化物的还原性比W的弱 | |
| D. | W比Y更容易与氢气反应 |
| A. | 乙醇分子中有1个氢原子与其他氢原子不一样 | |
| B. | 乙醇分子可认为是由乙烷分子中的一个-H被一个-OH取代产生的 | |
| C. | 乙醇分子中的每个碳原子都形成了四个共价键,但显示化合价不是+4价 | |
| D. | 乙醇的相对分子质量为46,相对分子质量为46的有机物就是乙醇 |
①加成反应②氧化反应③加氢反应④消去反应⑤取代反应⑥水解反应⑦酯化反应⑧加聚反应.
| A. | ①③④⑤ | B. | ③⑦⑧ | C. | ④⑥⑧ | D. | ①④⑥ |
| A. | 酸式滴定管未用标准盐酸润洗,直接装入标准盐酸 | |
| B. | 酸式滴定管滴定前有气泡,滴定后气泡消失 | |
| C. | 滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥 | |
| D. | 读取醋酸体积时,开始仰视读数,滴定结束后俯视读数 |
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | B. |  1,3,4-三甲苯 1,3,4-三甲苯 | ||
| C. | CH3CH2CH(OH)CH3 2-丁醇 | D. |  2-甲基-3-丁炔 2-甲基-3-丁炔 |
| A. | 水 | B. | NaNO3溶液 | C. | NaCl溶液 | D. | CuSO4粉末 |
 或
或 .
.