题目内容
18.NA为阿伏加德罗常数,下列叙述错误的是( )| A. | 28 g C2H4和C4H8混合气体中含有氢原子总数为4NA | |
| B. | 常温常压下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应小于0.1NA | |
| C. | 15g 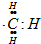 含有的电子数为9NA 含有的电子数为9NA | |
| D. | 2.1 g DTO中所含中子数为NA |
分析 A、C2H4和C4H8的最简式均为CH2;
B、常温常压下气体摩尔体积大于22.4L/mol;
C、求出甲基的物质的量,然后根据甲基中含9个电子来分析;
D、求出DTO的物质的量,然后根据DTO中含11个中子来分析.
解答 解:A、C2H4和C4H8的最简式均为CH2,故28g混合物中含有的CH2的物质的量为2mol,故含4NA个H原子,故A正确;
B、常温常压下气体摩尔体积大于22.4L/mol,故正极生成的氢气的物质的量小于0.05mol,则转移的电子数小于0.1NA个,故B正确;
C、15g甲基的物质的量为1mol,而甲基中含9个电子,故1mol甲基中含9NA个电子,故C正确;
D、2.1gDTO的物质的量为0.1mol,而DTO中含11个中子,故1molDTO中含1.1NA个中子,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
19.下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最大的是( )
| 编号 | 金属(粉末状)(mol) | 酸的浓度及体积 | 反应温度(℃) |
| A | Mg,0.1 | 6mol•L-1硝酸10mL | 60 |
| B | Mg,0.1 | 3mol•L-1盐酸10mL | 60 |
| C | Fe,0.1 | 3mol•L-1盐酸100mL | 60 |
| D | Mg,0.1 | 3mol•L-1硫酸5mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
20.如图是锌锰电池的内部结构示意图,下列说法错误的是( )
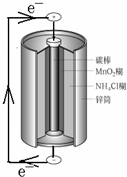

| A. | 锌筒作负极,发生氧化反应 | |
| B. | 电子从锌流向碳棒,碳棒得电子被还原 | |
| C. | 电池内部的NH4+向碳棒移动 | |
| D. | 将NH4Cl更换为KOH能提高电池寿命和性能 |
3.用过量硝酸银溶液处理0.01mol氯化铬水溶液,产生0.02mol AgCl沉淀,则此氯化铬最可能是( )
| A. | [Cr(H2O)6]Cl3 | B. | [Cr(H2O)5Cl]Cl2•H2O | ||
| C. | [Cr(H2O)4Cl2]Cl•2H2O | D. | [Cr(H2O)3Cl3]•3H2O |
 工业上可利用乙烯和水在催化剂、加热和加压条件下反应制备乙醇,实验室中可利用乙醇和浓硫酸(浓硫酸的作用是催化剂和脱水剂)在170℃的温度下反应制备乙烯
工业上可利用乙烯和水在催化剂、加热和加压条件下反应制备乙醇,实验室中可利用乙醇和浓硫酸(浓硫酸的作用是催化剂和脱水剂)在170℃的温度下反应制备乙烯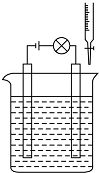 实验探究离子之间是否发生了反应.
实验探究离子之间是否发生了反应. (用电子式表示).
(用电子式表示).