题目内容
13. 工业上可利用乙烯和水在催化剂、加热和加压条件下反应制备乙醇,实验室中可利用乙醇和浓硫酸(浓硫酸的作用是催化剂和脱水剂)在170℃的温度下反应制备乙烯
工业上可利用乙烯和水在催化剂、加热和加压条件下反应制备乙醇,实验室中可利用乙醇和浓硫酸(浓硫酸的作用是催化剂和脱水剂)在170℃的温度下反应制备乙烯(1)写出乙烯和水反应生成乙醇的化学方程式:CH2=CH2+H2O$→_{加热、加压}^{催化剂}$CH3CH2OH
(2)写出乙醇生成乙烯的化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
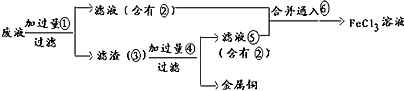
(3)经预测,由乙醇生成乙烯气体中混有碳氧化物和二氧化硫,然后将该混合气体进行如图所示实验(各种试剂均足量)A中品红溶液颜色完全退去,B中溴水颜色变浅,C中品红溶液不变色,D中澄清石灰水变浑浊.①C中品红溶液的作用是检验二氧化硫是否除尽,②B中发生的化学反应的类型是加成反应、氧化还原反应,③纯净气体的化学式是CO
(4)在乙醇和浓硫酸反应的容器中,浓硫酸的作用除了催化剂和脱水剂以外,还有吸水性、氧化性.
分析 (1)乙烯中含有碳碳双键,一定条件下,乙烯和水发生加成反应生成乙醇;
(2)乙醇与浓硫酸混合加热到170℃发生消去反应生成乙烯;
(3)二氧化硫能使品红褪色,A是用品红检验二氧化硫;B中是乙烯与溴水发生加成反应且还有二氧化硫与溴水的氧化还原反应;C是检验二氧化硫是否除尽;D是检验二氧化碳;E是吸收二氧化碳;
(4)浓硫酸具有催化剂、脱水剂、吸水剂的作用.
解答 解:(1)乙烯中含有碳碳双键,在一定条件下,乙烯和水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O$→_{加热、加压}^{催化剂}$CH3CH2OH,
故答案为:CH2=CH2+H2O$→_{加热、加压}^{催化剂}$CH3CH2OH;
(2)乙醇与浓硫酸混合加热到170℃发生消去反应生成乙烯,反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(3)由乙醇生成乙烯气体中混有碳氧化物和二氧化硫,A中品红溶液颜色完全退去,说明混合气体中含有二氧化硫,B中溴水颜色变浅,是乙烯与溴水发生加成反应且还有二氧化硫与溴水的氧化还原反应的结果,溴水的颜色不褪去,说明乙烯和二氧化硫消耗完全,溴水过量,C中品红溶液不变色,说明二氧化硫已除尽,D中澄清石灰水变浑浊是碳的氧化物二氧化碳与氢氧化钙反应生成碳酸钙,E是吸收二氧化碳,由于每一种试剂的量都是足量,最后得到的气体只有一氧化碳,故答案为:检验二氧化硫是否除尽;加成反应、氧化还原反应;CO;
(4)浓硫酸具有催化剂、脱水剂、吸水剂、强氧化剂的作用,故答案为:吸水性、氧化性.
点评 本题考查了乙烯性质,属于中等难度的试题,侧重对学生能力的培养和训练,明确物质的结构和性质是解题关键,注意反应条件的书写.

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案| A. | N2 | B. | CO2 | C. | SO2 | D. | CH4 |
 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:| 元素 | 相关信息 |
| T | 基态原子2p能级有3个单电子 |
| W | 基态原子p轨道上成对电子数等于未成对电子数 |
| X | 氢化物常用于刻蚀玻璃 |
| Y | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
| Z | 原子序数等于X与Y的原子序数之和 |
(2)42gT的单质分子中π键的个数为3NA;在T的最简单氢化物分子中T原子的杂化类型是sp3.研究者预想合成一个纯粹由T元素组成的新物种T5+T3-,若T5+离子中每个氮原子均满足8电子且呈对称结构,以下有关T5+推测正确的是BD(填序号)
A.N5+有24个电子
B.N5+阳离子中存在两个氮氮三键
C.N5+离子中存在三对未成键的电子对
D.N3-离子的空间构型为直线型
(3)TX3是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.它可在Z单质的催化作用下由X2和过量的TH3反应得到,试写出该反应的化学方程式:4NH3+3F2$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F.在该反应方程式中的几种物质所属的晶体类型有acd(填序号).
a.离子晶体 b.原子晶体 c.分子晶体 d.金属晶体
(4)T、W、X 3种元素的电负性由大到小的顺序为F>O>N(用元素符号表示).
(5)Z2+能与T的氢化物写出配位数为4的配离子[Z(TH3)4]2+,该配离子具有对称的空间构型,且离子中的两个TH3被两个Cl取代只能得到一种产物,则[Z(TH3)4]2+的空间构型为正四面体.
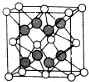
(6)X和Y形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g•cm-3,阿伏加德罗常数为NA,则晶胞边长a=$\root{3}{\frac{312ρ}{{N}_{A}}}$cm.(用ρ、NA的计算式表示).
| A. | 28 g C2H4和C4H8混合气体中含有氢原子总数为4NA | |
| B. | 常温常压下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应小于0.1NA | |
| C. | 15g 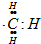 含有的电子数为9NA 含有的电子数为9NA | |
| D. | 2.1 g DTO中所含中子数为NA |
| A. | 摩尔是国际单位制中的七大基本物理量之一 | |
| B. | 1 mol任何物质都约含有6.02×1023个原子 | |
| C. | 以克为单位时,2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 | |
| D. | 在同温同压下,气体所占的体积主要由气体分子的物质的量决定 |
| A. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,该反应的热化学方程式是 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.4 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石一定比石墨稳定 | |
| C. | 已知:断裂1mol H2(g)、1molCl2(g)、1molHCl(g)中化学键吸收的能量分别是E1、E2、E3,则H2(g)+Cl2 (g)=2HCl(g)的反应热△H=2×E3-(E1+E2) | |
| D. | 已知C(s)+O2(g)=CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)=2CO(g),△H=b kJ•mol-1,则2CO(g)+O2(g)=2CO2(g)△H=(2a-b) kJ•mol-1 |