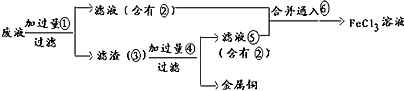
题目内容
20.如图是锌锰电池的内部结构示意图,下列说法错误的是( )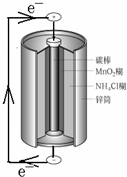
| A. | 锌筒作负极,发生氧化反应 | |
| B. | 电子从锌流向碳棒,碳棒得电子被还原 | |
| C. | 电池内部的NH4+向碳棒移动 | |
| D. | 将NH4Cl更换为KOH能提高电池寿命和性能 |
分析 锌-锰干电池属于原电池,锌失电子作负极,二氧化锰得电子发生还原反应,所以二氧化锰发生反应的电极碳棒作正极,电子从负极沿导线流向正极,据此分析解答.
解答 解:A.锌失电子作负极,发生氧化反应,故A正确;
B.锌失电子作负极,碳棒作正极,二氧化锰在碳棒得电子发生还原反应,故B错误;
C.电池工作时,阳离子移向正极,故C正确;
D.金属材料在碱性电解质中比在酸性电解质中的稳定性提高,所以若用湿的KOH替代电解质NH4Cl,可延长电池寿命和提高电池性能,故D正确;
故选B.
点评 本题考查原电池原理,根据原电池正负极上得失电子来分析解答即可,注意常见电源的构成,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )
| A. | 原子半径由小到大的顺序:X<Y<Z<W | |
| B. | Z的最高价氧化物能与水反应生成相应的酸 | |
| C. | 室温下,0.1 mol/L W的气态氢化物的水溶液的pH>1 | |
| D. | Y单质在一定条件下可以与氧化铁发生置换反应 |
11.下列有关金属的说法正确的是( )
| A. | 湿法炼铜和火法炼铜的反应中,铜元素都发生还原反应 | |
| B. | 加强热,使CuO在高温条件下分解制备单质Cu | |
| C. | 黑色金属材料包括铁、铬、锰及其化合物 | |
| D. | 生铁与钢的区别在于生铁含碳杂质,而钢不含 |
8.可逆反应:N2(g)+3H2(g)?2NH3(g)的正逆反应速率可用反应物或生成物的浓度变化来表示,下列各关系中能说明反应已达平衡状态的是( )
| A. | v正(N2)=v正(H2) | B. | v正(N2)=v逆(NH3) | ||
| C. | 2 v正(H2)=3 v逆(NH3) | D. | v正(N2)=v逆(H2) |
5.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeC12溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在KI-淀粉试纸上,试纸变蓝色.下列判断正确的是( )
| A. | 实验①生成的气体不能使湿润的KI-淀粉试纸变蓝 | |
| B. | 实验②证明Fe2+既有氧化性又有还原性 | |
| C. | 上述实验证明氧化性:MnO4->CI2>Fe3+>I2 | |
| D. | 上述实验中,共有两个氧化还原反应 |
18.NA为阿伏加德罗常数,下列叙述错误的是( )
| A. | 28 g C2H4和C4H8混合气体中含有氢原子总数为4NA | |
| B. | 常温常压下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应小于0.1NA | |
| C. | 15g 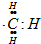 含有的电子数为9NA 含有的电子数为9NA | |
| D. | 2.1 g DTO中所含中子数为NA |