题目内容
20. 天然化合物M(假蜜环菌素)的结构简式如图所式.对M的结构与性质叙述错误的是( )
天然化合物M(假蜜环菌素)的结构简式如图所式.对M的结构与性质叙述错误的是( )| A. | M的分子式为C12H10O5 | |
| B. | M能发生取代反应、加成反应、氧化反应、还原反应 | |
| C. | M中碳原子之间全部以C-C键或C=C键相互结合 | |
| D. | M的同分异构体最多含有2个与乙酸相同的官能团 |
分析 该物质中含有酚羟基、苯环、醇羟基、酯基和羰基、碳碳双键,具有酚、苯、醇、酯和酮、烯烃的性质,能发生氧化反应、取代反应、显色反应、水解反应、加成反应等,以此解答该题.
解答 解:A.由结构简式可知,M的分子式为C11H10O5,故A错误;
B.含有酚羟基,可发生取代、氧化反应,含有碳碳双键可发生加成反应,可被还原,故B正确;
C.分子中存在C=O键,故C错误;
D.分子中含有5个O原子,可形成2个羧基,故D正确.
故选A C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、醇、酚、酯性质的考查,题目难度不大.

练习册系列答案
 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
19.根据如图提供的信息,下列所得结论正确的是( )
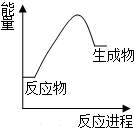

| A. | 生成物比反应物稳定 | |
| B. | 该反应的△H<0 | |
| C. | 该图可以表示石灰石高温分解反应 | |
| D. | 因为生成物的总能量高于反应物的总能量,所以该反应一定不能发生 |
11.某实验小组进行了“影响化学反应速率”的探究实验,原始数据记录如下:
(1)比较三组数据,初步得出的结论是:当其他条件不变时,H2SO4(填化学式)的浓度增加,反应速率加快(填“加快”、“减慢”或“不变”); 对比①、②两组实验,你认为影响反应速率的因素是固体接触面积.
(2)写出该反应的离子方程式Zn+2H+═Zn2++H2↑,
(3)经过试验对比,同学们在①组试验的试管中,滴入几滴CuSO4溶液后,锌粒表面有紫红色物质生成,同时发现试管中产生气泡的速度明显加快,请你分析,产生这种现象加快反应速率的原因是因为发生了原电池反应.
| Zn的质量 | H2SO4的浓度 | 收集20mL H2所需的时间 | |
| ① | 10g(锌粒) | 0.1mol/L | 153s |
| ② | 10g(锌粉) | 0.1mol/L | 125s |
| ③ | 10g(锌粉) | 0.2mol/L | 62s |
(2)写出该反应的离子方程式Zn+2H+═Zn2++H2↑,
(3)经过试验对比,同学们在①组试验的试管中,滴入几滴CuSO4溶液后,锌粒表面有紫红色物质生成,同时发现试管中产生气泡的速度明显加快,请你分析,产生这种现象加快反应速率的原因是因为发生了原电池反应.
15.盐酸、醋酸、碳酸钠和碳酸氢钠是生活中常见的物质,下列表述正确的是( )
| A. | NaHCO3溶液中存在:c(OH-)═c (H+)+c (H2CO3) | |
| B. | 25℃时,将pH=2的盐酸与pH=12的氨水混合后,溶液呈中性,则消耗溶液的体积:V(盐酸)<V(氨水) | |
| C. | pH相等的盐酸和CH3COOH溶液稀释到相同的pH,盐酸稀释的倍数大 | |
| D. | 将0.2mol/L的NaHCO3溶液和0.1mol/L的醋酸钠溶液等体积混合,溶液中存在:c(Na+)═c(CH3COOH)+c(CH3COO-)+c(CO32-)+c(HCO3-)+c(H2CO3) |
9.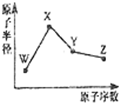 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )| A. | 对应简单离子半径:W>X | |
| B. | 对应气态氢化物的稳定性:Y<Z | |
| C. | 化合物XZW既含离子键,又含极性共价键 | |
| D. | Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应 |
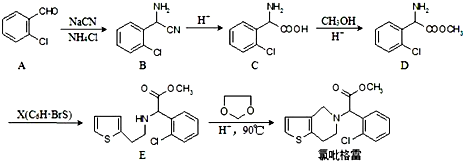
 ,
, ;
;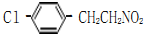 、
、 、
、
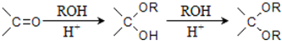
 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).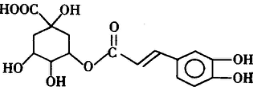
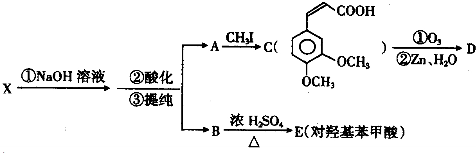
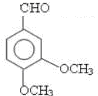 ;
;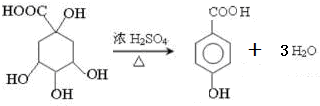 ;
;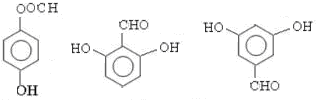 任意一种(任写一种)
任意一种(任写一种)