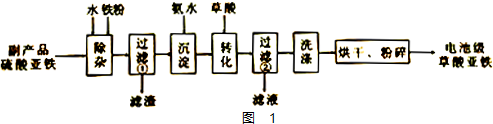
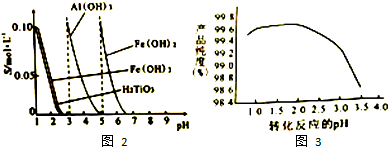
题目内容
10.指出下列反应的氧化剂、还原剂、氧化产物与还原产物.并且用双线桥法标出.Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
分析 Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2的反应中,Fe元素化合价由+3价变为0价、C元素化合价由+2价变为+4价,得电子化合价降低的反应物发生还原反应,失电子化合价升高的反应物发生氧化反应,以此解答该题.
解答 解:在 Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 的反应中,C元素的化合价升高,CO作还原剂,则C元素的原子失去电子,被氧化,对应氧化产物为CO2,Fe元素化合价降低,反应中得到电子被还原,Fe2O3作氧化剂,发生还原反应,对应还原产物为Fe,该反应中3molCO参加反应,转移6mol电子,则双线桥表示该反应电子转移的方向和数目为 ,
,
答:氧化剂为Fe2O3,还原剂为CO,氧化产物为CO2,还原产物为Fe,双线桥表示该反应电子转移的方向和数目为 .
.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、电子转移表示方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
20.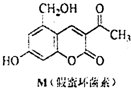 天然化合物M(假蜜环菌素)的结构简式如图所式.对M的结构与性质叙述错误的是( )
天然化合物M(假蜜环菌素)的结构简式如图所式.对M的结构与性质叙述错误的是( )
 天然化合物M(假蜜环菌素)的结构简式如图所式.对M的结构与性质叙述错误的是( )
天然化合物M(假蜜环菌素)的结构简式如图所式.对M的结构与性质叙述错误的是( )| A. | M的分子式为C12H10O5 | |
| B. | M能发生取代反应、加成反应、氧化反应、还原反应 | |
| C. | M中碳原子之间全部以C-C键或C=C键相互结合 | |
| D. | M的同分异构体最多含有2个与乙酸相同的官能团 |
1.醇(C5H12O)发生下列反应时,所得产物数目最少(不考虑立体异构)的是( )
| A. | 与浓氢溴酸卤代 | B. | 与浓硫酸共热消去 | ||
| C. | 铜催化下氧化 | D. | 与戊酸催化酯化 |
18.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价.下列说法不正确的是( )
| A. | X元素可以组成多种单质 | |
| B. | Y和Z可能在同一周期 | |
| C. | X与W形成的化合物和Z与W形成的化合物的化学键类型不同 | |
| D. | 元素X、Y、W的最高价氧化物对应水化物的酸性强弱:X<Y<W |
5.A、B、C、D 均为气体,对于A+3B?2C+D 的反应来说,以下化学反应速率的表示中反应速率最快的是( )
| A. | v(A)=0.4 mol/(L•s) | B. | v(B)=0.8 mol/(L•s) | C. | v(C)=0.6 mol/(L•s) | D. | v(D)=0.1 mol/(L•s) |
19.为解决全球能源与环境问题,节能减排已成共识.下列措施有利于节能减排的有( )
| A. | 举行“地球一小时”熄灯活动 | B. | 露天焚烧稻草和秸秆 | ||
| C. | 夏天将空调的温度设置在26℃以上 | D. | 生活垃圾分类回收处理 |
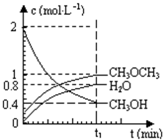 已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ•mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题:
已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ•mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题: