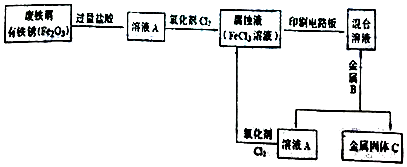
题目内容
3.化学平衡常数(K)、电离常数(Ka、Kb)、水的离子积(Kw)、水解常数(Kh)、溶度积常数(Ksp)等是表示、判断物质性质的重要常数,下列说法正确的是( )| A. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 | |
| B. | 降低温度时,弱酸和弱碱的电离常数(Ka、Kb)、水的离子积(Kw)均增大 | |
| C. | 向稀NaOH溶液中加入等体积等浓度的氯化镁和氯化铁混合溶液时,先产生红褐色沉淀,说明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] | |
| D. | 室温下,Kh(CH3COONa)<Kh(NaCN),则等物质的量浓度时,CH3COOH的酸性比HCN弱 |
分析 A.K只与温度有关;
B.弱酸和弱碱的电离、水的电离均为吸热反应;
C.先产生红褐色沉淀,可知先生成Fe(OH)3,Ksp小的先生成;
D.酸性越弱,对应盐水解程度越大.
解答 解:A.K只与温度有关,与浓度、压强、催化剂无关,故A错误;
B.弱酸和弱碱的电离、水的电离均为吸热反应,则降低温度,均降低,故B错误;
C.先产生红褐色沉淀,可知先生成Fe(OH)3,Ksp小的先生成,则Ksp[Mg(OH)2]>Ksp[Fe(OH)3],故C正确;
D.酸性越弱,对应盐水解程度越大,由Kh(CH3COONa)<Kh(NaCN),则等物质的量浓度时,CH3COOH的酸性比HCN强,故D错误;
故选C.
点评 本题考查平衡常数的意义,为高频考点,把握平衡常数、电离常数、水解常数的影响因素为解答的关键,侧重分析与应用能力的考查,注意选项A为解答的易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列混合物的分离和提纯方法中,主要是从溶解性的角度考虑的是( )
| A. | 蒸发 | B. | 蒸馏 | C. | 洗气 | D. | 萃取 |
14.下列关于合金的说法不正确的是( )
| A. | 合金只能由金属熔合而成 | |
| B. | 硬铝、黄铜、生铁均属于合金 | |
| C. | 焊锡(锡铅合金)熔点比金属锡低 | |
| D. | 合金的硬度可以大于它的纯金属成分 |
11.向1L含0.3molNaAlO2的溶液中缓慢通入二氧化碳,随n(CO2)增大,下列对应关系不正确的是( )
| 选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
| A | 0 | c(Na+)>c(AlO2-)>c(OH-)>c(H+) |
| B | 0.1 | c(Na+)>c(AlO2-)>c(CO32-)>c(OH-)>c(H+) |
| C | 0.2 | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| D | 0.3 | c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
| A. | A | B. | B | C. | C | D. | D |
18.在同温同压下,有同质量的气体甲与乙,已知此时甲的体积小于乙的体积.则下列说法正确的是( )
| A. | 甲的分子数比乙的分子数多 | |
| B. | 甲的摩尔体积比乙的摩尔体积小 | |
| C. | 甲的相对分子质量比乙的相对分子质量大 | |
| D. | 甲的物质的量比乙的物质的量少 |
8.下列说法中错误的是( )
| A. | 5 g 98%的硫酸(密度为1.84 g/cm3)与5 mL 18.4 mol/L硫酸的浓度是不同的 | |
| B. | 制成0.5 L 10 mol/L的盐酸,需要氯化氢气体112 L(标准状况) | |
| C. | 0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 | |
| D. | 从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L |
13.下列电子转移的表示正确的是( )
| A. | 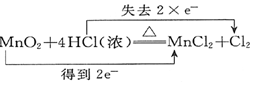 ↑+2H2O ↑+2H2O | B. | 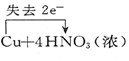 (浓)═Cu(NO3)2+2NO2↑+2H2O (浓)═Cu(NO3)2+2NO2↑+2H2O | ||
| C. | 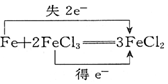 | D. | 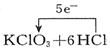 ═KCl+3Cl2↑+3H2O ═KCl+3Cl2↑+3H2O |