题目内容
12.(1)电子工业常用FeCl3溶液做腐蚀液制造印刷电路板.用FeCl3做腐蚀液与Cu反应的原理为:2FeCl3+Cu=2FeCl2+CuCl2将一定量铁粉和铜粉的混合物放入等浓度的FeCl3和CuCl2的混合溶液中,可发生多个反应,其中首先发生反应的离子方程式为:Fe+2Fe3+=3Fe2+.
(2)某校研究性学习小组用已生锈(Fe2O3)的废铁屑制作印刷电路板的腐蚀液(FeCl3溶液),并将刻蚀电路板后的废液再生为FeCl3溶液循环使用.实验流程如图:
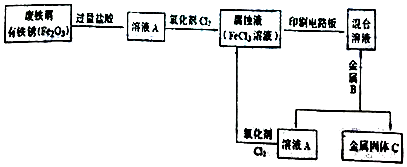
请根据使用流程写出下列反应的离子方程式:
溶液A→腐蚀液:2Fe2++Cl2=2Fe3++2Cl-.
混合溶液+金属B→金属固体C:Fe+Cu2+=Cu+Fe2+.
(3)检验腐蚀液中Fe3+存在的常用试剂是KSCN,证明Fe3+存在的现象是呈现血红色.
(4)取适量混合溶液于试管中,加入一定量的铁粉,若反应结束后试管中仍有少量固体,则固体中一定含有Cu,溶液中可能含有的金属阳离子是Cu2+.
分析 (1)氧化性与还原性越强,越易发生氧化还原反应;
(2)废铁屑与铁锈中加入过量盐酸,得到的A含有氯化亚铁,加入氧化剂氯气,可氧化氯化亚铁生成氯化铁,用于印刷电路板,得到的混合液含有氯化铜和氯化亚铁,加入金属B为Fe,金属固体C为铜,A为氯化亚铁,以此解答该题.
解答 解:(1)还原性Fe>Cu,氧化性Fe3+>Cu2+,氧化性与还原性越强,越易发生氧化还原反应,则首先发生反应的离子方程式为Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
(2)废铁屑与铁锈中加入过量盐酸,得到的A含有氯化亚铁,加入氧化剂氯气,可氧化氯化亚铁生成氯化铁,用于印刷电路板,得到的混合液含有氯化铜和氯化亚铁,加入金属B为Fe,金属固体C为铜,A为氯化亚铁,
溶液A含有氯化亚铁,可与氯气发生2Fe2++Cl2=2Fe3++2Cl-,混合液含有氯化铜和氯化亚铁,加入金属B为Fe,发生置换反应,离子方程式为Fe+Cu2+=Cu+Fe2+,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;Fe+Cu2+=Cu+Fe2+;
(3)检验铁离子,可加入KSCN,发生络合反应,溶液呈现血红色,故答案为:KSCN;呈现血红色;
(4)还原性Fe>Cu,氧化性Fe3+>Cu2+,加入一定量的铁粉,首先和铁离子反应,在和铜离子反应,若反应结束后试管中仍有少量固体,则一定含有铜,溶液中一定含有亚铁离子,可能含有铜离子,
故答案为:Cu; Cu2+.
点评 本题考查物质的分离和制备,为高频考点,侧重考查铁与铜的化合物的转化,明确实验的目的与原理是解题的关键,注意掌握氯气的化学性质及检验方法,试题侧重考查了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
2.关于如图各装置图的叙述中,正确的是( )

| A. | 装置丁可用于实验室制取并收集乙酸乙酯 | |
| B. | 装置乙可用于收集H2、NH3、CO2、Cl2、NO等气体 | |
| C. | 装置丙中X若为苯,可用于吸收氨气或氯化氢等易溶于水的气体,并能防止倒吸 | |
| D. | 装置甲中,d为阴极、c为阳极 |
3.化学平衡常数(K)、电离常数(Ka、Kb)、水的离子积(Kw)、水解常数(Kh)、溶度积常数(Ksp)等是表示、判断物质性质的重要常数,下列说法正确的是( )
| A. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 | |
| B. | 降低温度时,弱酸和弱碱的电离常数(Ka、Kb)、水的离子积(Kw)均增大 | |
| C. | 向稀NaOH溶液中加入等体积等浓度的氯化镁和氯化铁混合溶液时,先产生红褐色沉淀,说明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] | |
| D. | 室温下,Kh(CH3COONa)<Kh(NaCN),则等物质的量浓度时,CH3COOH的酸性比HCN弱 |
20.下列说法正确的是( )
| A. | 直径为20nm的纳米碳酸钙属于胶体 | |
| B. | 海水中含有钾元素,只需经过物理变化就可以得到钾单质 | |
| C. | 可溶性铁盐可用作净水剂 | |
| D. | 光导纤维是一种新型硅酸盐材料 |
7.下列说法正确的是( )
| A. | 一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应 | |
| B. | C3H6与C4H8一定互为同系物 | |
| C. | 全降解塑料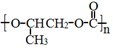 可由环氧丙烷 可由环氧丙烷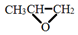 和CO2缩聚制得 和CO2缩聚制得 | |
| D. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g |
17.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A. | Na2O、MgO、Fe3O4均为金属氧化物,并且都是碱性氧化物 | |
| B. | CH3COONa、CuSO4、NaOH、H2S水溶液均能导电,并且都是强电解质 | |
| C. | 赤铁矿、磁铁矿、黄铁矿、孔雀石都含有铁元素,并且都是常见的铁矿石 | |
| D. | HClO、H2SO4、HNO3均具有氧化性,并且都是氧化性酸 |
4.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下NA个SO3的体积为22.4 L | |
| B. | 1 mol Fe与足量的HCl反应,转移的电子数为3NA | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| D. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA |
1.下列化合物中,既能发生消去反应,又能发生水解反应的是( )
| A. | 三氯甲烷 | B. | 2-丙醇 | C. | 2-氯丙烷 | D. | 乙酸乙酯 |
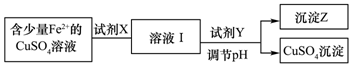
2.(1)刘安《淮南万毕术》中“曾青得铁则化为铜”是古代湿法炼铜的真实写照.除去CuSO4溶液中少量的Fe2+,可以按照下面的流程进行:
已知:Fe2+、Cu2+、Fe3+三种离子开始沉淀和完全沉淀时溶液pH值如表:
①下列物质中适合作为试剂X的是A
A.H2O2 B.KMnO4C.HNO3 D.Cl2
②加入的Y及调节的pH范围是A
A.Cu(OH)2 3.7~4.3 B.CuO 3.7~6.4
C. NaOH 3.7~4.2 D.NH3•H2O 3.7~4.0
(2)已知常温下,KspCu(OH)2]=2×10-20,通过上述流程得到的CuSO4溶液中,c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH大于5.

已知:Fe2+、Cu2+、Fe3+三种离子开始沉淀和完全沉淀时溶液pH值如表:
| 金属 离子 | pH | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
A.H2O2 B.KMnO4C.HNO3 D.Cl2
②加入的Y及调节的pH范围是A
A.Cu(OH)2 3.7~4.3 B.CuO 3.7~6.4
C. NaOH 3.7~4.2 D.NH3•H2O 3.7~4.0
(2)已知常温下,KspCu(OH)2]=2×10-20,通过上述流程得到的CuSO4溶液中,c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH大于5.