题目内容
14.下列关于合金的说法不正确的是( )| A. | 合金只能由金属熔合而成 | |
| B. | 硬铝、黄铜、生铁均属于合金 | |
| C. | 焊锡(锡铅合金)熔点比金属锡低 | |
| D. | 合金的硬度可以大于它的纯金属成分 |
分析 合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质,合金的熔点一般比成分金属低,硬度比成分金属大,据此分析.
解答 解:A.合金不一定只含有金属,如钢是碳和铁的合金,故A错误;
B.硬铝是铝、镁等金属的合金,黄铜是铜和锌等金属的合金,生铁是碳和铁的合金,故B正确;
C.合金的熔点一般比成分金属低,焊锡(锡铅合金)熔点比金属锡低,故C正确;
D.合金的硬度可以大于它的纯金属成分,故D正确.
故选A.
点评 本题考查合金的组成,题目难度不大,注意把握合金的定义以及合金的物理性质是解题的关键,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
5.相同质量的下列气体中电子数最少的是( )
| A. | O2 | B. | Cl2 | C. | N2 | D. | CO2 |
2.关于如图各装置图的叙述中,正确的是( )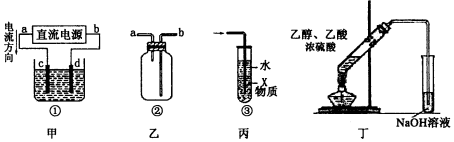

| A. | 装置丁可用于实验室制取并收集乙酸乙酯 | |
| B. | 装置乙可用于收集H2、NH3、CO2、Cl2、NO等气体 | |
| C. | 装置丙中X若为苯,可用于吸收氨气或氯化氢等易溶于水的气体,并能防止倒吸 | |
| D. | 装置甲中,d为阴极、c为阳极 |
9.下列离子方程式正确的是( )
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量的NaOH溶液 Al3++3OH-═Al(OH)3↓ | |
| C. | Fe3O4与稀硝酸溶液反应:2Fe3O4+18H+═6Fe3++H2↑+8H2O | |
| D. | NaHSO4溶液与足量Ba(OH)2溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
19.试根据碱金属元素性质的递变规律推测下列说法,其中不正确的是( )
| A. | Cs2CO3比CsHCO3稳定 | |
| B. | CsOH是一种强碱 | |
| C. | 可能存在Cs2O2 | |
| D. | Cs在金属活动性顺序表中排在K后面 |
3.化学平衡常数(K)、电离常数(Ka、Kb)、水的离子积(Kw)、水解常数(Kh)、溶度积常数(Ksp)等是表示、判断物质性质的重要常数,下列说法正确的是( )
| A. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 | |
| B. | 降低温度时,弱酸和弱碱的电离常数(Ka、Kb)、水的离子积(Kw)均增大 | |
| C. | 向稀NaOH溶液中加入等体积等浓度的氯化镁和氯化铁混合溶液时,先产生红褐色沉淀,说明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] | |
| D. | 室温下,Kh(CH3COONa)<Kh(NaCN),则等物质的量浓度时,CH3COOH的酸性比HCN弱 |
4.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下NA个SO3的体积为22.4 L | |
| B. | 1 mol Fe与足量的HCl反应,转移的电子数为3NA | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| D. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA |