题目内容
11.向1L含0.3molNaAlO2的溶液中缓慢通入二氧化碳,随n(CO2)增大,下列对应关系不正确的是( )| 选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
| A | 0 | c(Na+)>c(AlO2-)>c(OH-)>c(H+) |
| B | 0.1 | c(Na+)>c(AlO2-)>c(CO32-)>c(OH-)>c(H+) |
| C | 0.2 | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| D | 0.3 | c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.0.3molNaAlO2的溶液中A|lO2-离子水解溶液显碱性;
B.0.3molNaAlO2的溶液中通入0.1molCO2反应生成氢氧化铝和碳酸钠,2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3;
C.0.3molNaAlO2的溶液中通入0.2molCO2反应生成氢氧化铝和碳酸钠,2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,CO2+H2O+Na2CO3=2NaHCO3,
D.0.3molNaAlO2的溶液中通入0.3molCO2反应生成氢氧化铝和碳酸氢钠,反应的化学方程式NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,
解答 解:A.0.3molNaAlO2的溶液中A|lO2-离子水解溶液显碱性,溶液中离子浓度大小为:c(Na+)>c(AlO2-)>c(OH-)>c(H+),故A正确;
B.0.3molNaAlO2的溶液中通入0.1molCO2反应生成氢氧化铝和碳酸钠,2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,得到溶液中为0.1molNaAlO2和0.1molNa2CO3,
溶液中偏铝酸根离子水解程度大于碳酸根离子,离子浓度大小c(Na+)>c(CO32-)>c(AlO2-)>c(OH-)>c(H+),故B错误;
C.0.3molNaAlO2的溶液中通入0.2molCO2反应生成氢氧化铝和碳酸钠,
2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,
2 1 1
0.3mol 0.15mol 0.15mol
剩余二氧化碳0.05mol,反应碳酸钠0.05mol,
CO2+H2O+Na2CO3=2NaHCO3,
1 1 2
0.05mol 0.05mol 0.1mol
得到溶液中0.1molNa2CO3,0.1molNaHCO3,碳酸根离子水解程度大于碳酸氢根离子水解,c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C正确;
D.0.3molNaAlO2的溶液中通入0.3molCO2反应生成氢氧化铝和碳酸氢钠,反应的化学方程式NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,得到溶液为碳酸氢钠溶液,溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(H+),故D正确;
故选B.
点评 本题考查了化学反应产物判断、盐类水解、离子浓度大小比较等,掌握基础是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | H+和CO32- | B. | HCO3-和HSO4- | C. | Na+、HCO3-和H+ | D. | HCO3-和H+ |
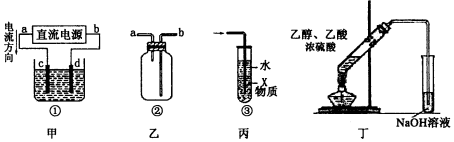
| A. | 装置丁可用于实验室制取并收集乙酸乙酯 | |
| B. | 装置乙可用于收集H2、NH3、CO2、Cl2、NO等气体 | |
| C. | 装置丙中X若为苯,可用于吸收氨气或氯化氢等易溶于水的气体,并能防止倒吸 | |
| D. | 装置甲中,d为阴极、c为阳极 |
| A. | Cs2CO3比CsHCO3稳定 | |
| B. | CsOH是一种强碱 | |
| C. | 可能存在Cs2O2 | |
| D. | Cs在金属活动性顺序表中排在K后面 |
| A. | CuCl2具有一定的氧化性 | |
| B. | 电解CuCl2水溶液时,阳极一定得到Cu单质 | |
| C. | Cu(OH)2•CuCl2 属于碱式盐 | |
| D. | 制备无水CuCl2时,需要在HCl气流中加热脱水 |
| A. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 | |
| B. | 降低温度时,弱酸和弱碱的电离常数(Ka、Kb)、水的离子积(Kw)均增大 | |
| C. | 向稀NaOH溶液中加入等体积等浓度的氯化镁和氯化铁混合溶液时,先产生红褐色沉淀,说明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] | |
| D. | 室温下,Kh(CH3COONa)<Kh(NaCN),则等物质的量浓度时,CH3COOH的酸性比HCN弱 |
| A. | 直径为20nm的纳米碳酸钙属于胶体 | |
| B. | 海水中含有钾元素,只需经过物理变化就可以得到钾单质 | |
| C. | 可溶性铁盐可用作净水剂 | |
| D. | 光导纤维是一种新型硅酸盐材料 |
| A. | 三氯甲烷 | B. | 2-丙醇 | C. | 2-氯丙烷 | D. | 乙酸乙酯 |