题目内容
15.在标准状况下22.4L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为16g.分析 标况下22.4L混合气体的物质的量n=$\frac{V}{Vm}$=1mol,设氮气的物质的量为xmol,氧气的物质的量为ymol,根据物质的量为1mol,质量为30g可知:x+y=1 ①
28x+32y=30 ②,然后依据m=nM计算氧气的质量.
解答 解:标况下22.4L混合气体的物质的量n=$\frac{V}{Vm}$=1mol,设氮气的物质的量为xmol,氧气的物质的量为ymol,根据物质的量为1mol,质量为30g可知:x+y=1 ①
28x+32y=30 ②
解①②可得y=0.5mol.则氧气的质量m=nM=ymol×32g/mol=0.5mol×32g/mol=16g,
故答案为:16.
点评 本题考查了物质的量的有关计算,熟练掌握公式的运用是解题的关键,难度不大,注意基础的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.相同质量的下列气体中电子数最少的是( )
| A. | O2 | B. | Cl2 | C. | N2 | D. | CO2 |
3.化学平衡常数(K)、电离常数(Ka、Kb)、水的离子积(Kw)、水解常数(Kh)、溶度积常数(Ksp)等是表示、判断物质性质的重要常数,下列说法正确的是( )
| A. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 | |
| B. | 降低温度时,弱酸和弱碱的电离常数(Ka、Kb)、水的离子积(Kw)均增大 | |
| C. | 向稀NaOH溶液中加入等体积等浓度的氯化镁和氯化铁混合溶液时,先产生红褐色沉淀,说明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] | |
| D. | 室温下,Kh(CH3COONa)<Kh(NaCN),则等物质的量浓度时,CH3COOH的酸性比HCN弱 |
10.下列说法正确的是( )
| A. | 16gO2与16gO3体积比为3:2 | |
| B. | 由H2、O2组成的混合气,密度是氢气的8.5倍,混合气中H2的质量分数为50% | |
| C. | 将标况下22.4L的HCl气体溶于1 L水中配制1mol/L的HCl溶液 | |
| D. | 1mL 3mol/L的K2SO4溶液和100mL 1mol/L的Al2(SO4)3溶液,SO42-浓度相同 |
20.下列说法正确的是( )
| A. | 直径为20nm的纳米碳酸钙属于胶体 | |
| B. | 海水中含有钾元素,只需经过物理变化就可以得到钾单质 | |
| C. | 可溶性铁盐可用作净水剂 | |
| D. | 光导纤维是一种新型硅酸盐材料 |
7.下列说法正确的是( )
| A. | 一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应 | |
| B. | C3H6与C4H8一定互为同系物 | |
| C. | 全降解塑料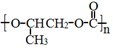 可由环氧丙烷 可由环氧丙烷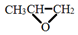 和CO2缩聚制得 和CO2缩聚制得 | |
| D. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g |
4.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下NA个SO3的体积为22.4 L | |
| B. | 1 mol Fe与足量的HCl反应,转移的电子数为3NA | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| D. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA |
5. 在25℃下,稀释HA、HB两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积.下列说法正确的是( )
在25℃下,稀释HA、HB两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积.下列说法正确的是( )
 在25℃下,稀释HA、HB两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积.下列说法正确的是( )
在25℃下,稀释HA、HB两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积.下列说法正确的是( )| A. | lg$\frac{{V}_{2}}{{V}_{1}}$=6时,HA溶液的pH=8 | |
| B. | pH相同时,c(HA)>c(HB) | |
| C. | 曲线上a、b两点 $\frac{[{B}^{-}]}{[HB][O{H}^{-}]}$ 一定不相等 | |
| D. | 25℃时,NaA溶液的pH一定小于NaB溶液 |