题目内容
10.下列各项叙述中,正确的是( )| A. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| B. | 第一电离能由小到大的顺序是S<P<Cl | |
| C. | 47Ag原子的价层电子排布式是4d95s2 | |
| D. | 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是p区元素 |
分析 A.由基态转化成激发态,需要吸收能量;
B.非金属性越强,第一电离能越大,但P的3p电子半满为稳定结构;
C.47Ag原子的价层电子排布式是4d105s1;
D.价电子排布为5s25p1的元素,最外层电子数为3.
解答 解:A.镁原子由1s22s22p63s2→1s22s22p63p2时,由基态转化成激发态,需要吸收能量,故A错误;
B.非金属性越强,第一电离能越大,但P的3p电子半满为稳定结构,则第一电离能由小到大的顺序是S<P<Cl,故B正确;
C.全满、半满为稳定结构,则47Ag原子的价层电子排布式是4d105s1,故C错误;
D.价电子排布为5s25p1的元素,最外层电子数为3,则元素位于第五周期第ⅢA族,是p区元素,故D错误;
故选B.
点评 本题考查周期表及应用,为高频考点,把握原子结构与元素位置的关系、电子排布与位置、性质的关系为解答的关键,侧重分析与应用能力的考查,题目难度中等.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
7.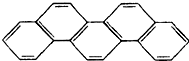 有一种有机物,因其酷似奥林匹克五环旗(如图),科学家称其为“奥林匹克烃”,下列有关“奥林匹克烃”的说法正确的是( )
有一种有机物,因其酷似奥林匹克五环旗(如图),科学家称其为“奥林匹克烃”,下列有关“奥林匹克烃”的说法正确的是( )
 有一种有机物,因其酷似奥林匹克五环旗(如图),科学家称其为“奥林匹克烃”,下列有关“奥林匹克烃”的说法正确的是( )
有一种有机物,因其酷似奥林匹克五环旗(如图),科学家称其为“奥林匹克烃”,下列有关“奥林匹克烃”的说法正确的是( )| A. | 该有机物属芳香烃 | |
| B. | 该物质属氨基酸 | |
| C. | 该物质分子中只含非极性键 | |
| D. | 该物质完全燃烧产生水的物质的量小于CO2的物质的量 |
5.下列物质性质与应用对应关系正确的是( )
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| C. | 氢氟酸具有弱酸性,可用于蚀刻玻璃 | |
| D. | H2O2具有还原性,可用于与酸性高锰酸钾溶液反应制取少量氧气 |
15.已知反应:①101Kpa时,2C(s)+O2(g)═2CO(g);△H=-221kJ/mol
②稀溶液中,H +(aq)+OH-(aq)═H2O(1);△H=-57.3kJ/mol
下列结论正确的是( )
②稀溶液中,H +(aq)+OH-(aq)═H2O(1);△H=-57.3kJ/mol
下列结论正确的是( )
| A. | 碳的燃烧热大于 110.5 kJ/mol | |
| B. | ①的反应热为 221 kJ/mol | |
| C. | 稀硫酸与稀 NaOH溶液反应的中和热为-57.3kJ/mol | |
| D. | 稀醋酸与稀 NaOH溶液反应生成 1mol水,放出 57.3kJ热量 |
19.决定元素种类的是( )
| A. | 质子数 | B. | 电子数 | C. | 中子数 | D. | 质子数和中子数 |
20.下列叙述中,正确的是( )
| A. | 中和10 mL 0.1 mol•L-1 醋酸与中和100 mL 0.01 mol•L-1的醋酸所需同种碱溶液的量不同 | |
| B. | 常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液中,由水电离产生的c(OH-)相等 | |
| C. | 向NH4Cl溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强 | |
| D. | 向饱和石灰水中加入少量CaO,恢复至室温后溶液中c(OH-)增大,导电能力增强 |
