题目内容
7.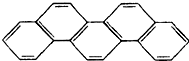 有一种有机物,因其酷似奥林匹克五环旗(如图),科学家称其为“奥林匹克烃”,下列有关“奥林匹克烃”的说法正确的是( )
有一种有机物,因其酷似奥林匹克五环旗(如图),科学家称其为“奥林匹克烃”,下列有关“奥林匹克烃”的说法正确的是( )| A. | 该有机物属芳香烃 | |
| B. | 该物质属氨基酸 | |
| C. | 该物质分子中只含非极性键 | |
| D. | 该物质完全燃烧产生水的物质的量小于CO2的物质的量 |
分析 该有机物含有C和H元素,为烃,含有稠环,为芳香族化合物,分子中含有C-C、C-H键,分子式为C22H14,以此解答该题.
解答 解:A.分子中含有苯环,属于芳香烃,故A正确;
B.不含氨基、羧基,不是氨基酸,故B错误;
C.分子中含有C-C、C-H键,C-H键为极性键,故C错误;
D.该烃分子式为C22H14,由碳原子、氢原子守恒,可知1mol该物质完全燃烧生成CO2的物质的量为22mol,生成H2O的物质的量为7mol,故D正确.
故选AD.
点评 本题考查有机物的结构和性质,为高考常见题型,注意把握有机物的组成、结构和性质,把握相关概念以及同系物的特征,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.利用下列实验装置完成相应的实验,能达到实验目的是( )
| A. |  实验室中制取少量蒸馏水 | B. |  分离碘和酒精 | ||
| C. |  称量氢氧化钠固体 | D. |  配制100 mL 0.10 mol•L-1盐酸 |
18.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,11.2LHF中含有H-F键的数目为0.5NA | |
| B. | 常温下,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 电解饱和食盐水,阳极产生22.4L气体时,电路中通过的电子数目为2NA |
15.青蒿素对治疗疟疾有很好的效果,下列说法正确的是( )


| A. | 青蒿素易溶于水和酒精 | |
| B. | 青蒿素中含多个环状结构,其中有一个六元碳环 | |
| C. | 青蒿素中含过氧键,过氧键属于极性共价键 | |
| D. | 青蒿素和纤维素都属于高分子化合物 |
12.将38.4gCu与含有2mol HNO3的浓硝酸反应至铜完全溶解后,再向溶液中加人铜时,发现铜不再溶解.则在铜完全溶解时所放出的气体体积(标准状况下)为( )
| A. | 17.92L | B. | 22.4L | C. | 8.96L | D. | 11.2L |
19.下列反应的离子方程式正确的是( )
| A. | 向Ba(0H)2溶液中滴H2SO4溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 明矾溶液中加氢氧化钡溶液,使其产生沉淀的物质的量达最大值:Al3++2SO42-+2Ba+4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | Mg(HCO3)2溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ | |
| D. | 向100mL0.1mol/L的FeBr2溶液中通入0.012molCl2:10Fe2++14Br-+12Cl2═10Fe3++7Br2+24Cl- |
9.下列事实不能说明醋酸属于弱电解质的是( )
| A. | 0.1mol/L CH3COONa溶液显碱性 | |
| B. | 0.1mol/L醋酸溶液的pH=3 | |
| C. | 物质的量浓度相同的盐酸和醋酸同时与锌反应,开始时锌粒跟盐酸反应比跟醋酸反应的速率快 | |
| D. | 中和100mL1mol/L 的CH3COOH溶液需要100mL1mol/L的NaOH溶液 |
10.下列各项叙述中,正确的是( )
| A. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| B. | 第一电离能由小到大的顺序是S<P<Cl | |
| C. | 47Ag原子的价层电子排布式是4d95s2 | |
| D. | 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是p区元素 |
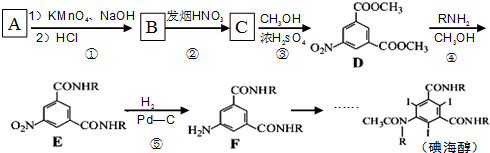
 .
.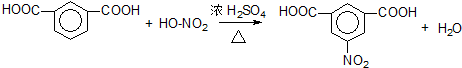 .
. 、
、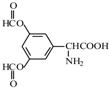 .
.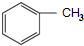 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体 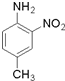 的合成路线流
的合成路线流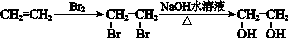
 呈弱碱性,易被氧化
呈弱碱性,易被氧化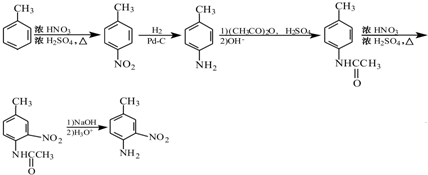 .
.