题目内容
15.已知反应:①101Kpa时,2C(s)+O2(g)═2CO(g);△H=-221kJ/mol②稀溶液中,H +(aq)+OH-(aq)═H2O(1);△H=-57.3kJ/mol
下列结论正确的是( )
| A. | 碳的燃烧热大于 110.5 kJ/mol | |
| B. | ①的反应热为 221 kJ/mol | |
| C. | 稀硫酸与稀 NaOH溶液反应的中和热为-57.3kJ/mol | |
| D. | 稀醋酸与稀 NaOH溶液反应生成 1mol水,放出 57.3kJ热量 |
分析 A、1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热,CO燃烧生成二氧化碳继续放出热量;
B、反应热包含符号,①的反应热为-221 kJ•mol-1;
C、中和热是强酸强碱稀溶液全部反应生成1mol水放出的热量;
D、醋酸是弱电解质,电离过程需吸收热量.
解答 解:A、由反应①可知,1mol碳燃烧生成CO放出的热量为110.5 kJ,CO燃烧生成二氧化碳继续放出热量,故1mol碳完全燃烧放出的热量大于110.5 kJ,所以碳的燃烧热大于110.5 kJ/mol,故A正确;
B、反应热包含符号,①的反应热为-221 kJ•mol-1,故B错误;
C、中和热为放热反应,则叙述中和热时不用“-”,即稀硫酸与稀NaOH溶液反应的中和热为57.3kJ•mol-1,故C错误;
D、醋酸是弱电解质,电离需吸收热量,稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3 kJ,故D错误;
故选A.
点评 本题考查学生对于反应热、中和热的理解及有关计算等,难度中等,注意稀的强酸、强碱的中和热为△H=-57.3kJ/mol.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
12.将38.4gCu与含有2mol HNO3的浓硝酸反应至铜完全溶解后,再向溶液中加人铜时,发现铜不再溶解.则在铜完全溶解时所放出的气体体积(标准状况下)为( )
| A. | 17.92L | B. | 22.4L | C. | 8.96L | D. | 11.2L |
6.已知32g X与40g Y恰好完全反应,生成m g Q和9g H,在相同条件下,16g X和足量Y混合生成0.25mol Q和若干摩的H,则物质Q的摩尔质量应是( )
| A. | 122 g•mol-1 | B. | 63 g•mol-1 | C. | 126 g•mol-1 | D. | 163 g•mol-1 |
10.下列各项叙述中,正确的是( )
| A. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| B. | 第一电离能由小到大的顺序是S<P<Cl | |
| C. | 47Ag原子的价层电子排布式是4d95s2 | |
| D. | 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是p区元素 |
20.设NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 1mol NH4+和1mol OH-所含电子数均为10NA | |
| B. | 14gC2H4和14gC3H6 所含原子数均为3NA | |
| C. | 1L l mol/LH2SO4溶液与足量Zn充分反应生成22.4L H2 | |
| D. | 标准状况下,11.2LSO3所含分子数为0.5NA |
7.二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如图1:
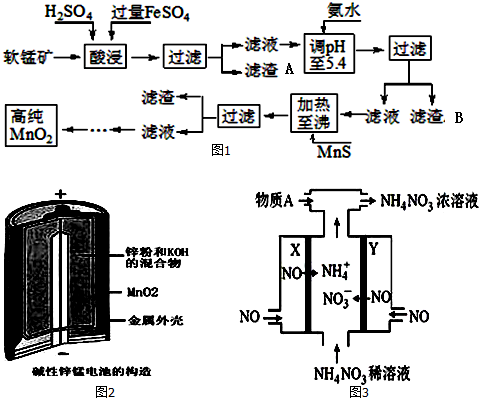
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH如表,回答下列问题
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为MnO2+2FeSO4+2H2SO4═MnSO4+Fe2(SO4)3+2H2O.
(2)滤渣A的主要成分是SiO2;滤渣B的主要成分是Fe(OH)3、Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.可能原因是CuS、ZnS的溶解度较MnS小.
(4)碱性锌锰电池是一种一次性电池,其结构如图2所示.该电池放电过程产生MnOOH.该电池的正极反应式为MnO2+H2O+e-═MnO(OH)+OH-,电池总反应的方程式为Zn+2MnO2+2H2O═2MnOOH+ZnOH)2.
(5)利用该碱性锌锰电池电解NO制备NH4NO3,其工作原理如图3所示,X电极阴极,电解时阳极的电极反应为NO-3e-+2H2O=NO3-+4H+,使电解产物全部转化为NH4NO3,需补充物质A,A是NH3.

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH如表,回答下列问题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(2)滤渣A的主要成分是SiO2;滤渣B的主要成分是Fe(OH)3、Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.可能原因是CuS、ZnS的溶解度较MnS小.
(4)碱性锌锰电池是一种一次性电池,其结构如图2所示.该电池放电过程产生MnOOH.该电池的正极反应式为MnO2+H2O+e-═MnO(OH)+OH-,电池总反应的方程式为Zn+2MnO2+2H2O═2MnOOH+ZnOH)2.
(5)利用该碱性锌锰电池电解NO制备NH4NO3,其工作原理如图3所示,X电极阴极,电解时阳极的电极反应为NO-3e-+2H2O=NO3-+4H+,使电解产物全部转化为NH4NO3,需补充物质A,A是NH3.
4.已知:S(s)+O2(g)→SO2(g)+297.16kJ,2SO2(g)+O2(g)═2SO3(g)+196.6kJ,下列说法正确的是( )
| A. | 1molSO2(g)的能量总和大于lmolS(s)和lmolO2(g)的能量总和 | |
| B. | 将2molSO2(g)与lmolO2(g)在一定条件下充分反应,放出196.6kJ的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q,Q值小于297.16kJ | |
| D. | 当lmolS(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
5.一瓶Na2SO3已部分被氧化,必须通过实验确定其纯度,正确的操作顺序是( )
①称取样品;②用蒸馏水溶解样品;③过滤;④在烘箱中烘干沉淀;
⑤向溶液中加过量的用盐酸酸化的BaCl2溶液;⑥用蒸馏水洗涤沉淀并再用AgNO3溶液检验,不出现沉淀为止;⑦准确称量干燥沉淀的质量;⑧在干燥器中冷却;⑨计算.
①称取样品;②用蒸馏水溶解样品;③过滤;④在烘箱中烘干沉淀;
⑤向溶液中加过量的用盐酸酸化的BaCl2溶液;⑥用蒸馏水洗涤沉淀并再用AgNO3溶液检验,不出现沉淀为止;⑦准确称量干燥沉淀的质量;⑧在干燥器中冷却;⑨计算.
| A. | ①②③⑥⑤④⑧⑦⑨ | B. | ①②⑤③⑥④⑧⑦⑨ | C. | ①②③④⑤⑧⑥⑦⑨ | D. | ①②③⑤⑥④⑧⑦⑨ |