题目内容
保险丝是由武德合金制成的,武的合金是用50%铋、25%的铅、12.5%锡和12.5%的镉制成的,武德合金用于电器业主要是利用武德合金的( )
| A、熔点 | B、硬度 |
| C、稳定性 | D、导电性 |
考点:合金的概念及其重要应用
专题:元素及其化合物
分析:保险丝的作用:在电路中电流过大时,产生的电热过多,达到保险丝的熔点,保险丝熔断,切断电路,以此解答该题.
解答:
解:合金的特点是熔点低,保险丝选择熔点较低的合金丝,在电流过大时,保险丝的温度升高,达到保险丝的熔点,保险丝熔断,切断电源,起到保护电路的作用,与硬度、稳定性以及导电性无关.
故选A.
故选A.
点评:本题考查合金的性质,为高频考点,侧重于化学与生活的考查,有利于培养学生的良好的科学素养,难度不大,注意合金的特点是熔点低,硬度大.

练习册系列答案
相关题目
下列表示溶液中发生反应的化学方程式错误的是( )
| A、100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 mol CH3COOH:CO32-+CH3COOH═HCO3-+CH3COO- |
| B、向HCOOK和KOH混合溶液中加入KMnO4:2KMnO4+HCOOK+KOH═2K2MnO4+CO2 ↑+H2O |
| C、4mol/L 的NaAlO2溶液和7mol/L 的盐酸等体积均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ |
| D、在含有Mn2+的溶液中加入HNO3、再加入PbO2,则反应体系显紫红色:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O |
电离常数(Ka和Kb)、溶度积常数(Ksp)是判断物质性质的重要常数,下列关于这些常数的运算或运用正确的是( )
| A、某亚硫酸溶液pH=4.3,若忽略二级电离,则其一级电离平衡常数K1=1.0×l0-8.60 |
| B、Ka( HCN)<Ka( CH3COOH).说明同浓度时氢氰酸的酸性比醋酸强 |
| C、Ksp( AgI)<Ksp( AgCl),向AgCl悬浊液中加入KI溶液会出现黄色沉淀 |
| D、Ksp( AgBr)<Ksp( AgCl),说明AgBr和AgCl均不溶于稀硝酸 |
常温下,等浓度等体积的下列各组物质的溶液混合时,pH>7的是( )
| A、NaCl、CuSO4、Ba(NO3)2 |
| B、AlCl3、NaOH、KNO3 |
| C、K2CO3、HNO3、HCl |
| D、Na2S、HCl、KCl |
下列变化过程一定需要加入还原剂才能实现的是( )
| A、KClO3→KCl |
| B、CO2→C |
| C、Fe→Fe2+ |
| D、NaCl→HCl |
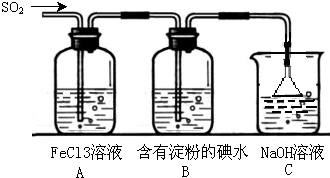 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: