题目内容
常温下,等浓度等体积的下列各组物质的溶液混合时,pH>7的是( )
| A、NaCl、CuSO4、Ba(NO3)2 |
| B、AlCl3、NaOH、KNO3 |
| C、K2CO3、HNO3、HCl |
| D、Na2S、HCl、KCl |
考点:盐类水解的应用
专题:
分析:常温下,物质的量浓度相同、体积也相同,则物质的物质的量相同,则
A、等物质的量的三种物质混合发生:CuSO4+Ba(NO3)2=BaSO4↓+Cu(NO3)2;
B、等物质的量AlCl3、NaOH、KNO3混合,三种物质之间发生反应后剩余AlCl3、KNO3;
C、等物质的量的K2CO3、HCl、HNO3混合,存在:n(H+)=2n(CO32-),发生:CO32-+2H+=H2O+CO2↑;
D、等物质的量的Na2S、KCl、HCl混合,发生:K2S+HCl=KCl+KHS;
根据混合后溶液生成物的性质进行判断溶液的酸碱性.
A、等物质的量的三种物质混合发生:CuSO4+Ba(NO3)2=BaSO4↓+Cu(NO3)2;
B、等物质的量AlCl3、NaOH、KNO3混合,三种物质之间发生反应后剩余AlCl3、KNO3;
C、等物质的量的K2CO3、HCl、HNO3混合,存在:n(H+)=2n(CO32-),发生:CO32-+2H+=H2O+CO2↑;
D、等物质的量的Na2S、KCl、HCl混合,发生:K2S+HCl=KCl+KHS;
根据混合后溶液生成物的性质进行判断溶液的酸碱性.
解答:
解:常温下,物质的量浓度相同、体积也相同,则物质的物质的量相同,则
A、等物质的量的三种物质混合发生:CuSO4+Ba(NO3)2=BaSO4↓+Cu(NO3)2,则pH=7,故A错误;
B、等物质的量AlCl3、KNO3、NaOH混合,混合后,氢氧化钠与氯化铝完全沉淀,混合后铝离子水解溶液呈酸性,pH<7,故B错误;
C、等物质的量的K2CO3、HCl、HNO3混合,存在:n(H+)=2n(CO32-),发生:CO32-+2H+=H2O+CO2↑,反应的溶液pH=7,如考虑CO2的溶解,则pH<7,故C错误;
D、等物质的量的Na2S、KCl、HCl混合,发生:Na2S+HCl=NaCl+NaHS,NaHS水解呈碱性,混合后,pH>7,故D正确;
故选D.
A、等物质的量的三种物质混合发生:CuSO4+Ba(NO3)2=BaSO4↓+Cu(NO3)2,则pH=7,故A错误;
B、等物质的量AlCl3、KNO3、NaOH混合,混合后,氢氧化钠与氯化铝完全沉淀,混合后铝离子水解溶液呈酸性,pH<7,故B错误;
C、等物质的量的K2CO3、HCl、HNO3混合,存在:n(H+)=2n(CO32-),发生:CO32-+2H+=H2O+CO2↑,反应的溶液pH=7,如考虑CO2的溶解,则pH<7,故C错误;
D、等物质的量的Na2S、KCl、HCl混合,发生:Na2S+HCl=NaCl+NaHS,NaHS水解呈碱性,混合后,pH>7,故D正确;
故选D.
点评:本题考查溶液混合后pH的判断,题目难度中等,注意把握题中各物质混合后生成物的性质,考虑盐类的水解.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
保险丝是由武德合金制成的,武的合金是用50%铋、25%的铅、12.5%锡和12.5%的镉制成的,武德合金用于电器业主要是利用武德合金的( )
| A、熔点 | B、硬度 |
| C、稳定性 | D、导电性 |
 甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.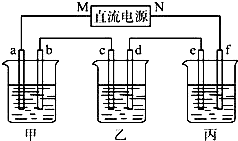 如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.
如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.