题目内容
电离常数(Ka和Kb)、溶度积常数(Ksp)是判断物质性质的重要常数,下列关于这些常数的运算或运用正确的是( )
| A、某亚硫酸溶液pH=4.3,若忽略二级电离,则其一级电离平衡常数K1=1.0×l0-8.60 |
| B、Ka( HCN)<Ka( CH3COOH).说明同浓度时氢氰酸的酸性比醋酸强 |
| C、Ksp( AgI)<Ksp( AgCl),向AgCl悬浊液中加入KI溶液会出现黄色沉淀 |
| D、Ksp( AgBr)<Ksp( AgCl),说明AgBr和AgCl均不溶于稀硝酸 |
考点:难溶电解质的溶解平衡及沉淀转化的本质,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.亚硫酸浓度未知,不能确定电离平衡常数;
B.电离平衡常数越大,酸性越强;
C.从难溶电解质的溶解平衡的角度分析;
D.Ksp大小与是否溶解于硝酸无关.
B.电离平衡常数越大,酸性越强;
C.从难溶电解质的溶解平衡的角度分析;
D.Ksp大小与是否溶解于硝酸无关.
解答:
解:A.电离平衡常数=
,亚硫酸浓度未知,不能确定电离平衡常数,故A错误;
B.电离平衡常数越大,酸性越强,则Ka( HCN)<Ka( CH3COOH),说明同浓度时氢氰酸的酸性比醋酸弱,故B错误;
C.Ksp( AgI)<Ksp( AgCl),向AgCl悬浊液中加入KI溶液,可生成更难溶的AgI沉淀,故C正确;
D.Ksp大小与是否溶解于硝酸无关,故D错误.
故选C.
| c(HSO3-)c(H+) |
| c(H2SO3) |
B.电离平衡常数越大,酸性越强,则Ka( HCN)<Ka( CH3COOH),说明同浓度时氢氰酸的酸性比醋酸弱,故B错误;
C.Ksp( AgI)<Ksp( AgCl),向AgCl悬浊液中加入KI溶液,可生成更难溶的AgI沉淀,故C正确;
D.Ksp大小与是否溶解于硝酸无关,故D错误.
故选C.
点评:本题考查较为综合,涉及弱电解质的电离、难溶电解质的溶解平衡,侧重于电离常数、溶度积常数的考查,注意把握平衡常数的意义,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
保险丝是由武德合金制成的,武的合金是用50%铋、25%的铅、12.5%锡和12.5%的镉制成的,武德合金用于电器业主要是利用武德合金的( )
| A、熔点 | B、硬度 |
| C、稳定性 | D、导电性 |
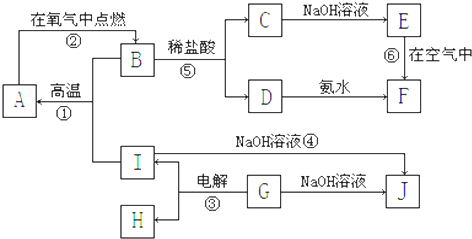
 甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.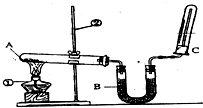 某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题:
某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题: