题目内容
下列表示溶液中发生反应的化学方程式错误的是( )
| A、100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 mol CH3COOH:CO32-+CH3COOH═HCO3-+CH3COO- |
| B、向HCOOK和KOH混合溶液中加入KMnO4:2KMnO4+HCOOK+KOH═2K2MnO4+CO2 ↑+H2O |
| C、4mol/L 的NaAlO2溶液和7mol/L 的盐酸等体积均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ |
| D、在含有Mn2+的溶液中加入HNO3、再加入PbO2,则反应体系显紫红色:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O |
考点:离子方程式的书写,化学方程式的书写
专题:离子反应专题
分析:A、由于碳酸钠过量,故少量的乙酸与碳酸钠反应只能生成碳酸氢钠,据此判断即可;
B、二氧化碳不能在碱性溶液中存在,据此分析可知甲酸钾的产物应为碳酸钾,据此判断即可;
C、依据反应AlO2-+H++H2O=Al(OH)3↓ AlO2-+4H+=Al3++H2O反应的定量关系分析判断产物;
D、在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色,说明朦胧中被氧化为高锰酸根离子,铅被还原为+2价.
B、二氧化碳不能在碱性溶液中存在,据此分析可知甲酸钾的产物应为碳酸钾,据此判断即可;
C、依据反应AlO2-+H++H2O=Al(OH)3↓ AlO2-+4H+=Al3++H2O反应的定量关系分析判断产物;
D、在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色,说明朦胧中被氧化为高锰酸根离子,铅被还原为+2价.
解答:
解:A、由于碳酸钠过量,故少量的乙酸与碳酸钠反应只能生成碳酸氢钠,故A正确;
B、二氧化碳不能在碱性溶液中存在,据此分析可知甲酸钾的产物应为碳酸钾,故正确化学反应方程式应为:2KMnO4+HCOOK+3KOH═2K2MnO4+K2CO3 +2H2O,故B错误;
C、依据反应AlO2-+H++H2O=Al(OH)3↓ AlO2-+4H+=Al3++H2O反应的定量关系分析判断,4mol?L-1的NaAlO2溶液和7mol?L-1的HCl等体积互相均匀混合,1:4<n(AlO2-):n(H+)<1;1,则反应完全离子方程式为4AlO2-+7H++H2O=3Al(OH)3↓+Al3+,故C正确;
D、在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色,说明锰离子被氧化为高锰酸根离子,铅被还原为+2价,反应的离子方程式5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O,故D正确,
故选B.
B、二氧化碳不能在碱性溶液中存在,据此分析可知甲酸钾的产物应为碳酸钾,故正确化学反应方程式应为:2KMnO4+HCOOK+3KOH═2K2MnO4+K2CO3 +2H2O,故B错误;
C、依据反应AlO2-+H++H2O=Al(OH)3↓ AlO2-+4H+=Al3++H2O反应的定量关系分析判断,4mol?L-1的NaAlO2溶液和7mol?L-1的HCl等体积互相均匀混合,1:4<n(AlO2-):n(H+)<1;1,则反应完全离子方程式为4AlO2-+7H++H2O=3Al(OH)3↓+Al3+,故C正确;
D、在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色,说明锰离子被氧化为高锰酸根离子,铅被还原为+2价,反应的离子方程式5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O,故D正确,
故选B.
点评:本题依托化学反应方程式以及离子反应方程式的书写,考查的学生对于过量问题的探究以及分析问题解决问题的能力,难度较大.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
下列推论正确的是( )
| A、S(g)+O2(g) SO2(g)△H1; S(s)+O2(g)=SO2(g)△H2,则:△H1>△H2 |
| B、C(石墨,S)=C(金刚石,S)△H=+l.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 |
| C、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H=-57.4 kJ/mol,则:含20 gNaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ |
| D、2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则碳的燃烧热等于110.5kJ/mol |
下列关于“16g氧气”的叙述中,错误的是( )
| A、物质的量为0.5mol |
| B、气体体积为11.2L |
| C、含有NA 个氧原子 |
| D、含有8 NA个电子 |
保险丝是由武德合金制成的,武的合金是用50%铋、25%的铅、12.5%锡和12.5%的镉制成的,武德合金用于电器业主要是利用武德合金的( )
| A、熔点 | B、硬度 |
| C、稳定性 | D、导电性 |
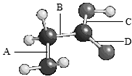 如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.
如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.