题目内容
15.查阅资料知,2Ag(银白色)+2HI═2AgI(黄色)+H2↑.选用药品和仪器将该反应设计成原电池.回答下列问题.供选用药品和仪器:银片、锌片、石墨、铜片、HI溶液、稀H2SO4溶液、AgNO3溶液和KI溶液、铜质导线、烧杯、U形管、电流表.
(1)2Ag(银白色)+2HI═2AgI(黄色)+H2↑的化学反应类型是氧化还原反应,负极材料为Ag.
(2)负极上的现象是Ag电极逐渐溶解、负极附近有黄色沉淀生成,负极的电极反应式为Ag-e-+I-=AgI↓.
(3)若消耗5.4g银.电路中转移电子0.05mol,收集到的氢气体积为560mL(标准状况).
分析 (1)原电池中,失电子发生氧化反应的电极是负极、得电子发生还原反应的电极是正极,根据电池反应式知,Ag失电子发生氧化反应、氢离子得电子发生还原反应,所以Ag是负极、不如Ag活泼的石墨作正极;
(2)负极上Ag溶解,生成的银离子和碘离子反应生成AgI黄色沉淀;
(3)根据Ag和转移电子之间的关系式计算转移电子物质的量,根据转移电子守恒计算生成氢气体积.
解答 解:(1)该反应方程式中,Ag元素化合价由0价变为+1价、H元素化合价由+1价变为0价,所以有电子转移,为氧化还原反应;原电池中,失电子发生氧化反应的电极是负极、得电子发生还原反应的电极是正极,根据电池反应式知,Ag失电子发生氧化反应、氢离子得电子发生还原反应,所以Ag是负极、不如Ag活泼的石墨作正极,
故答案为:氧化还原反应;Ag;
(2)负极上Ag溶解,生成的银离子和碘离子反应生成AgI黄色沉淀,所以看到的现象是:Ag电极逐渐溶解、负极附近有黄色沉淀生成,电极反应式为Ag-e-+I-=AgI↓,
故答案为:Ag电极逐渐溶解、负极附近有黄色沉淀生成;Ag-e-+I-=AgI↓;
(3)根据Ag和转移电子之间的关系式得转移电子物质的量=$\frac{5.4g}{108g/mol}×1$=0.05mol,根据转移电子守恒计算生成氢气体积=$\frac{0.05mol}{2}×22.4L/mol$=560mL,
故答案为:0.05;560.
点评 本题考查原电池设计,为高频考点,侧重考查学生分析判断及计算能力,明确原电池元素化合价变化与正负极的关系是解本题关键,难点是电极反应式的书写,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
6.晶体硅是一种重要的非金属材料,模拟制备纯硅的主要步骤如下:
②高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl$\frac{\underline{\;300℃\;}}{\;}$SiHCl3+H2,
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
可能用到的信息如下:
已知SiHCl3能与H2O强烈反应,在空气中易自燃;
步骤②中粗硅与HCl反应时会生成少量SiCl4;
请回答下列问题:
(1)粗硅与HCl反应完全后,依据上表所示沸点差异提纯SiHCl3.该提纯方法为分馏.
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
①依次连接的合理顺序为DBCAE;;
装置D中g管的作用是平衡压强;
装置B中的试剂是浓硫酸;
装置C中的烧瓶加热的目的是使滴入烧瓶中的SiHCl3气化.
②装置A中发生反应的化学方程式为SiHCl3+H2$\frac{\underline{\;1000℃-1100℃\;}}{\;}$Si+3HCl.
③操作时应先打开装置D(C或D)中分液漏斗的旋塞,理由是:因为SiHCl3容易在空气自燃,实验中还要注意先通一段时间H2排尽装置中的空气.
(3)请设计实验证明产品硅中是否含微量铁单质:将产品用稀盐酸溶解,取上层清液后先滴加氯水,再滴加硫氰化钾溶液,溶液显红色.
②高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl$\frac{\underline{\;300℃\;}}{\;}$SiHCl3+H2,
| 沸点/℃ | |
| SiHCl3 | 33.0 |
| SiCl4 | 57.6 |
| HCl | -84 |
可能用到的信息如下:
已知SiHCl3能与H2O强烈反应,在空气中易自燃;
步骤②中粗硅与HCl反应时会生成少量SiCl4;
请回答下列问题:
(1)粗硅与HCl反应完全后,依据上表所示沸点差异提纯SiHCl3.该提纯方法为分馏.
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①依次连接的合理顺序为DBCAE;;
装置D中g管的作用是平衡压强;
装置B中的试剂是浓硫酸;
装置C中的烧瓶加热的目的是使滴入烧瓶中的SiHCl3气化.
②装置A中发生反应的化学方程式为SiHCl3+H2$\frac{\underline{\;1000℃-1100℃\;}}{\;}$Si+3HCl.
③操作时应先打开装置D(C或D)中分液漏斗的旋塞,理由是:因为SiHCl3容易在空气自燃,实验中还要注意先通一段时间H2排尽装置中的空气.
(3)请设计实验证明产品硅中是否含微量铁单质:将产品用稀盐酸溶解,取上层清液后先滴加氯水,再滴加硫氰化钾溶液,溶液显红色.
3.催化技术可处理汽车尾气:2NO+2CO?2CO2+N2,某温度下在容积不变的密闭容器中通入NO 和CO,不同时间NO 和CO 的浓度如下表.下列说法中不正确的是( )
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2 s 内的平均反应速率υ(N2)=1.875×10-4 mol•L-1•s-1 | |
| B. | 在该温度下K=5 | |
| C. | 若将容积缩小为原来的一半,NO 转化率大于90% | |
| D. | 某时刻再充入0.1 mol NO,0.36 mol CO,重新达平衡后CO 浓度比原平衡大 |
10.大多数有机物都能燃烧,目前人类活动所需要的能源中,化石燃料占有相当比重,请回答下列问题:
(1)某烃充分燃烧后,产生CO2和H2O的物质的量之比为2:3,则该烃的实验式为CH3.
(2)在100℃、1.01×105Pa下,1L乙炔和丙烷的混合气体与8LO2混合,经充分燃烧后,恢复到起始温度和压强,所得气体总体积为9L,则原混合气体中乙炔和丙烷体积比为1:1.
(3)已知下列几种物质的燃烧热:
相同质量的上述四种物质,在标况下充分燃烧后,放出热量最多的是C2H6(写化学式).
(1)某烃充分燃烧后,产生CO2和H2O的物质的量之比为2:3,则该烃的实验式为CH3.
(2)在100℃、1.01×105Pa下,1L乙炔和丙烷的混合气体与8LO2混合,经充分燃烧后,恢复到起始温度和压强,所得气体总体积为9L,则原混合气体中乙炔和丙烷体积比为1:1.
(3)已知下列几种物质的燃烧热:
| 物质 | C | CO | C2H6 | C2H5OH |
| 燃烧热/KJ•mol-1 | 393.5 | 283 | 1559.8 | 1366.8 |
2.下列有关实验装置进行的相应实验,能达到实验目的是( )

| A. | 用图①所示装置制取少量纯净的CO2气体 | |
| B. | 用图②所示装置验证镁和盐酸反应的热效应 | |
| C. | 用图③所示装置制取并收集干燥纯净的NH3 | |
| D. | 用图④装置制备Fe(OH)2并能保证较长时间观察到白色 |
9.将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO 2、N 2O 4)的混合物共0.9mol,这些气体恰好能被500mL 2.0mol/L NaOH溶液完全吸收,溶液中生成NaNO 3和NaNO 2,则原混合气体中NO的物质的量为( )
| A. | 0.3mol | B. | 0.4mol | C. | 0.5mol | D. | 0.6mol |
7.元素的周期数等于( )
| A. | 电子层数 | B. | 原子量 | C. | 次外层电子数 | D. | 最外层电子数 |
 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示: $→_{①光照}^{Cl_{2}}$[A]$\stackrel{②}{→}$[B]$→_{③△}^{Cu、O_{2}}$[C]$\stackrel{④}{→}$[D]$→_{⑤ROH/△}^{浓硫酸}$[DMP]
$→_{①光照}^{Cl_{2}}$[A]$\stackrel{②}{→}$[B]$→_{③△}^{Cu、O_{2}}$[C]$\stackrel{④}{→}$[D]$→_{⑤ROH/△}^{浓硫酸}$[DMP] 的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.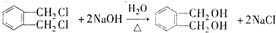 .
. .
. 制备DMP的另一种途径:
制备DMP的另一种途径: $→_{O_{2}①}^{催化剂、△}$
$→_{O_{2}①}^{催化剂、△}$ $→_{F②}^{适当条件}$[DMP]
$→_{F②}^{适当条件}$[DMP]