题目内容
10.大多数有机物都能燃烧,目前人类活动所需要的能源中,化石燃料占有相当比重,请回答下列问题:(1)某烃充分燃烧后,产生CO2和H2O的物质的量之比为2:3,则该烃的实验式为CH3.
(2)在100℃、1.01×105Pa下,1L乙炔和丙烷的混合气体与8LO2混合,经充分燃烧后,恢复到起始温度和压强,所得气体总体积为9L,则原混合气体中乙炔和丙烷体积比为1:1.
(3)已知下列几种物质的燃烧热:
| 物质 | C | CO | C2H6 | C2H5OH |
| 燃烧热/KJ•mol-1 | 393.5 | 283 | 1559.8 | 1366.8 |
分析 (1)产生CO2和H2O的物质的量之比为2:3,则C、H原子个数为2:6=1:3;
(2)令混合烃的平均分子式为CxHy,燃烧方程式为:CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O,因为100℃时,生成的H2O是气体,反应前后气体的体积不变,则:1+x+$\frac{y}{4}$=x+$\frac{y}{2}$,解得y=4;
(3)质量相同的上述物质,计算出其各自的物质的量,结合燃烧热即可求出放热多少大小比较.
解答 解:(1)产生CO2和H2O的物质的量之比为2:3,则C、H原子个数为2:6=1:3,则该烃的实验式为CH3,故答案为:CH3;
(2)令混合烃的平均分子式为CxHy,燃烧方程式为:CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O,因为100℃时,生成的H2O是气体,反应前后气体的体积不变,则:1+x+$\frac{y}{4}$=x+$\frac{y}{2}$,解得y=4,乙炔和丙烷的分子式分别为C2H2、C2H6,当二者比值为1:1时,可满足燃烧前后体积不变,故答案为:1:1;
(3)假设质量都为100g,则
C放出的热量为$\frac{100}{12}$×393.5kJ=3279kJ;
CO放出的热量为$\frac{100}{28}$×283kJ=1011kJ;
C2H6放出的热量为$\frac{100}{30}$×1559.8 kJ=5199kJ;
C2H5OH放出的热量为$\frac{100}{46}$×1366.8kJ=2971kJ,
则放出热量最多的为C2H6,
故答案为:C2H6.
点评 本题考查有机物的混合计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握题给信息以及有机物的分子式的计算,难度不大.

| A. | 5.6 g 铁粉与足量水蒸气反应,失去的电子数为0.3NA | |
| B. | 制取标准状况下22.4 L Cl2,需转移的电子数为2NA | |
| C. | 2.3 g Na在空气中完全燃烧,失去的电子数为0.1NA | |
| D. | 标准状况下3.36 L HF里含有的原子总数为0.3NA |
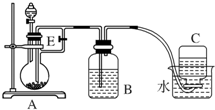 如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验提供的试剂:铁屑、6mol/L硫酸溶液、NaOH溶液.下列说法错误的是( )
如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验提供的试剂:铁屑、6mol/L硫酸溶液、NaOH溶液.下列说法错误的是( )| A. | B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑 | |
| B. | 实验开始时应先将活塞E关闭 | |
| C. | 生成Fe(OH)2的操作为:关闭E,使A中溶液压入B瓶中 | |
| D. | 取下装置B中的橡皮塞,使空气进入,有关反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
| A. | 等于12.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 无法确定 |
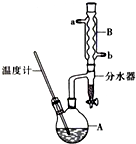 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下
| 相对分子质量 | 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为先加正丁醇,再加浓H2SO4或将浓H2SO4滴加到正丁醇中.
写出步骤②中制备正丁醚的化学方程式2CH3CH2CH2CH2OH
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(5)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃b. 117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为:正丁醇,下层液体的主要成分为水.(填物质名称)
(7)本实验中,正丁醚的产率为33.85%.
 对叔丁基苯酚
对叔丁基苯酚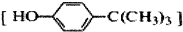 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下: .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
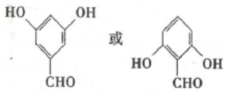
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.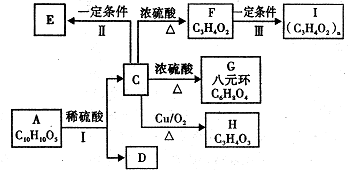
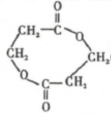 ,反应Ⅲ的化学方程式为
,反应Ⅲ的化学方程式为 .
.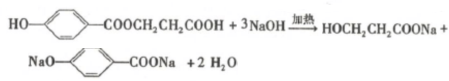 .
. .
. 原子序数小于36 的X、Y、Z、W 四种元素,其中X 形成的单质是最轻的物质,Y 原子基态时最外层电子数是其内层电子数的2 倍,Z 原子基态时2p 原子轨道上有3 个未成对的电子,W 的原子序数为29.回答下列问题:
原子序数小于36 的X、Y、Z、W 四种元素,其中X 形成的单质是最轻的物质,Y 原子基态时最外层电子数是其内层电子数的2 倍,Z 原子基态时2p 原子轨道上有3 个未成对的电子,W 的原子序数为29.回答下列问题: