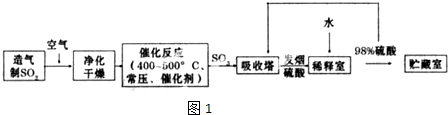
题目内容
5.制取4.78kg的普通玻璃(化学式为Na2O•CaO•6SiO2)的同时产生的CO2在标准状况下的体积是多少L?分析 发生反应:Na2CO3+CaCO3+6SiO2$\frac{\underline{\;高温\;}}{\;}$Na2O•CaO•6SiO2+2CO2↑,根据方程式计算生成二氧化碳的体积.
解答 解:Na2O•CaO•6SiO2的摩尔质量为478g/mol,n(Na2O•CaO•6SiO2)=$\frac{4780g}{478g/mol}$=10mol,
设生成CO2在标准状况下的体积为V(CO2),则:
Na2CO3+CaCO3+6SiO2$\frac{\underline{\;高温\;}}{\;}$Na2O•CaO•6SiO2+2CO2↑
1mol 44.8L
10mol V(CO2)
所以1mol:10mol=44.8L:V(CO2)
解得V(CO2)=448L
答:产生的CO2在标准状况下的体积是448L.
点评 本题以普通玻璃制备为载体,考查化学方程式计算,注意利用总反应方程式解答,熟练掌握中学常见化学工业.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
15.如图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略).
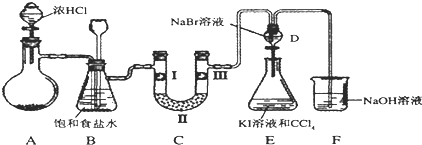
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中的化学反应方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O
该反应中的氧化剂是KMnO4,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是1mol;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入d(填编号);(碱石灰为NaOH与CaO混合物,无水氯化钙为中性干燥剂)
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到D中无色溶液逐渐变为橙黄色,若打开D装置的活塞,使D中溶液滴入E装置(KI溶液与CCl4),振荡锥形瓶后静置一会儿,可以观察到的现象是E中液体分为两层,下层(CCl4层)为紫红色;
(5)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式2NaOH+Cl2=NaCl+NaClO+H2O.

(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中的化学反应方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O
该反应中的氧化剂是KMnO4,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是1mol;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入d(填编号);(碱石灰为NaOH与CaO混合物,无水氯化钙为中性干燥剂)
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 无水氯化钙 | 碱石灰 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式2NaOH+Cl2=NaCl+NaClO+H2O.
10.下列实验“操作和现象”与“结论”都正确的是( )
| 操作和现象 | 结 论 | |
| A | 向盛有2mL0.1mol/LAgNO3溶液的试管中,先滴几滴0.1mol/LKCl溶液,再滴加0.1mol/LKI溶液.试管中先出现白色沉淀,后出现淡黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 在分液漏斗中加入碘水后再加入CCl4,充分振荡,分层,下层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| D | 测定饱和NaClO溶液、CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) | 弱酸的酸性:HClO<CH3COOH |
| A. | A | B. | B | C. | C | D. | D |

 .
.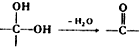
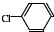 中氯原子较难水解物质A(
中氯原子较难水解物质A( 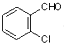 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式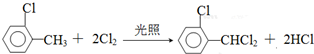 、
、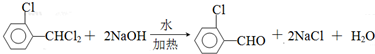 .该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式
.该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式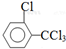 、
、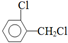 .
.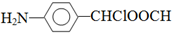 .
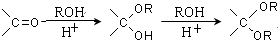
.
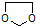 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
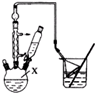 对叔丁基苯酚
对叔丁基苯酚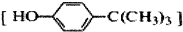 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下: .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.