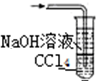
题目内容
3.催化技术可处理汽车尾气:2NO+2CO?2CO2+N2,某温度下在容积不变的密闭容器中通入NO 和CO,不同时间NO 和CO 的浓度如下表.下列说法中不正确的是( )| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2 s 内的平均反应速率υ(N2)=1.875×10-4 mol•L-1•s-1 | |
| B. | 在该温度下K=5 | |
| C. | 若将容积缩小为原来的一半,NO 转化率大于90% | |
| D. | 某时刻再充入0.1 mol NO,0.36 mol CO,重新达平衡后CO 浓度比原平衡大 |
分析 A.2s内△c(NO)=(1-0.25)×10-3 mol•L-1=7.5×10-4 mol•L-1,则△c(N2)=$\frac{1}{2}$△c(NO)=3.75×10-4 mol•L-1,再根据v=$\frac{△c}{△t}$计算v(N2);
B.4s时处于平衡状态,计算平衡常二氧化碳、氮气浓度,再根据K=$\frac{{c}^{2}(C{O}_{2})c({N}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$计算平衡常数;
C.原平衡时NO转化率为$\frac{(1-0.1)×1{0}^{-3}mol/L}{1×1{0}^{-3}mol}$=90%,若将容积缩小为原来的一半,增大压强,平衡正向移动;
D、体积不变,加入一氧化碳的量增加,所以达到新平衡,相应的浓度也会增加.
解答 解:A.2s内△c(NO)=(1-0.25)×10-3 mol•L-1=7.5×10-4 mol•L-1,则△c(N2)=$\frac{1}{2}$△c(NO)=3.75×10-4 mol•L-1,则v(N2)=$\frac{3.75×1{0}^{-4}mol/L}{2s}$=1.875×10-4mol•L-1•s-1,故A正确;
B.4s时处于平衡状态,平衡时NO为1.0×10-3 mol•L-1,则:
2NO(g)+2CO(g)?2CO2(g)+N2(g)
起始量(×10-3 mol•L-1):1 3.6 0 0
变化量(×10-3 mol•L-1):0.9 0.9 0.9 0.45
平衡量(×10-3 mol•L-1):0.1 2.7 0.9 0.45
则平衡常数K=$\frac{{c}^{2}(C{O}_{2})c({N}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$=$\frac{(0.9×1{0}^{-3})^{2}×(0.45×1{0}^{-3})}{(0.1×1{0}^{-3})^{2}×(2.7×1{0}^{-3})^{2}}$=5000,故B错误;
C.原平衡时NO转化率为$\frac{(1-0.1)×1{0}^{-3}mol/L}{1×1{0}^{-3}mol}$=90%,若将容积缩小为原来的一半,增大压强,平衡正向移动,NO转化率增大,故新平衡时NO转化率大于90%,故C正确;
D、某时刻再充入0.1 mol NO,0.36 mol CO,因为体积不变,加入一氧化碳的量增加,所以达到新平衡,CO的浓度也会增加,比原平衡的大,故D正确.
故选B.
点评 本题考查化学平衡计算与影响因素、反应速率计算与含义、化学平衡常数等,难度不大,注意三段式在化学平衡计算中应用.

| A. | 该溶液中,K+、Ca2+、Cl2、Br -可以大量共存 | |
| B. | 与足量Ca( OH)2溶液反应的离子方程式:Ca2++OH-+HS03═CaS03↓+H20 | |
| C. | 与FeCI3溶液反应的离子方程式:SO32-+2 Fe3++H20═SO42-+2Fe2++2H+ | |
| D. | 能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具有漂白性 |
| A. | W分子中碳、氢质量比为1:2 | B. | W同分异构体有5种 | ||
| C. | 经红外光谱测定W最多有4个甲基 | D. | 在核磁共振氢谱中W最少有2个峰 |
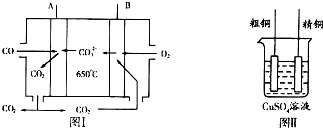
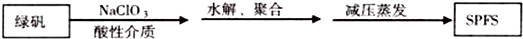
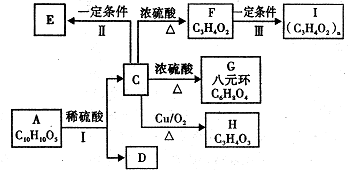
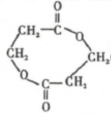 ,反应Ⅲ的化学方程式为
,反应Ⅲ的化学方程式为 .
.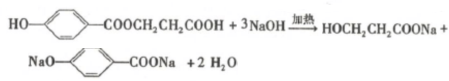 .
.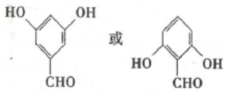 .
.