题目内容
13.常温下0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是( )| A. | c(H+) | B. | c(H+)•c(OH-) | C. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ |
分析 醋酸为弱酸,稀释过程中醋酸的电离程度增大,溶液中氢离子、醋酸根离子的物质的量增大,醋酸的物质的量减小,由于溶液体积变化程度更大,则溶液中氢离子、醋酸根离子、醋酸的浓度减小;由于水的离子积不变,则溶液中氢氧根离子浓度增大,据此进行解答.
解答 解:A.CH3COOH溶液加水稀释过程中,由于溶液体积增大,而醋酸的电离程度较小,则稀释后溶液中c(H+)减小,故A正确;
B.溶液中c(H+)•c(OH-)之积为水的离子积,稀释后溶液温度不变,则水的离子积不变,故B错误;
C.稀释过程中氢离子的物质的量增大、醋酸的物质的量减小,由于在同一溶液中,溶液体积相同,则$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值增大,故C错误;
D.稀释过程中氢离子浓度减小,氢氧根离子浓度增大,则$\frac{c(O{H}^{-})}{c({H}^{+})}$的比值增大,故D错误;
故选A.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确影响电离平衡的因素为解答关键,注意醋酸在稀释过程中氢离子浓度减小、氢氧根离子浓度增大,为易错点,试题培养了学生的灵活应用基础知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)催化剂能加快化学反应速率的原因是降低了活化能.
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为⇒H2O2?H++HO2-.
(3)实验①和②的目的是探究浓度对反应速率的影响.
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.
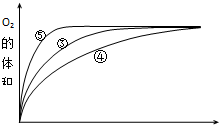
分析上图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为⇒H2O2?H++HO2-.
(3)实验①和②的目的是探究浓度对反应速率的影响.
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.

分析上图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
4.下列有关化学用语表示正确的是( )
| A. | 质子数和中子数均为6的碳原子:${\;}_{6}^{6}$C | |
| B. | 硫离子的结构示意图: | |
| C. | 氢氧化钠的电子式: | |
| D. | 氮气分子的电子式: , , |
5.有一种有机物C4H4其分子结构如图所示,有关该分子说法正确的是( )


| A. | 该分子是极性分子 | B. | 每个碳原子均为sp2杂化 | ||
| C. | 分子中有极性键和非极性键 | D. | 分子中共有4个碳碳键 |
2.利用右图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀盐酸 | MnO2 | 石蕊溶液 | 石蕊溶液先变红后褪色 | |
| B | 浓硫酸 | 蔗糖 | 品红 | 浓硫酸有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | 生成BaSO3白色沉淀 | |
| D | 醋酸 | Na2CO3 | 苯酚钠溶液 | 酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
3.下列事实描述不正确的是( )
| A. | 高温煅烧石灰石的反应中,反应物总能量高于生成物总能量 | |
| B. | 中和反应中,反应物总能量高于生成物总能量 | |
| C. | 铝粉和盐酸反应时,溶液温度通常会上升 | |
| D. | 氢氧化钡晶体和氯化铵晶体的反应是吸热反应 |

 .
.