题目内容
5. 金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用,利用铝热反应完成钢轨的焊接非常方便迅速.完成下列填空:
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用,利用铝热反应完成钢轨的焊接非常方便迅速.完成下列填空:(1)在特制漏斗中将铝热剂混合均匀后,引发铝热反应的操作是:铺上一层KClO3粉末,点燃插入的镁条.
(2)硅与铝同周期.地壳里硅铝的含量硅>铝(填>,<或=).工业上制备金属铝的化学方程式是:Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,工业上制备硅的化学方程式有:
a.SiO2+2C$\frac{\underline{\;高温\;}}{电炉}$Si(粗)+2CO b.SiO2+3C$\frac{\underline{\;高温\;}}{电炉}$SiC+2CO(副反应),
c.Si(粗)+2C12$\frac{\underline{\;高温\;}}{\;}$SiCl4 d.SiC14+2H2$\frac{\underline{\;加热\;}}{\;}$Si+4HC1,某同学将氧化还原反应、非氧化还原反应及四大基本反应绘制成图,其中属于图“2“区域的反应是b (填序号).
(3)SiO2是硅酸盐玻璃(Na2CaSi6O14)主要成分,Na2CaSi6O14也可写成Na2O•CaO•6SiO2,钠长石(NaAlSi3O8)的氧化物形式Na2O•Al2O3•6SiO2,长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同.由此可推知钙长石的化学式为CaAl2Si2O8.
(4)某铝合金由Al、Si、Cu、Mg组成.①称取100g该铝合金样品,分成等质量的A、B两份.向A份加入足量NaOH溶液,B份加入足量的稀盐酸.②待两份反应物都充分反应之后,称得滤渣质量相差1.60g,收集得到的两份气体的体积相差2240mL(标准状况下).则样品中Si和Mg的物质的量分别是n(Si)0.4mol和n(Mg)0.6mol.
分析 (1)可加入氯酸钾作助燃剂,点燃镁时反应放出大量的热,镁为引燃剂;
(2)地壳中含量排在前五位的元素分别是:O、Si、Al、Fe、Ca;工业上制备金属铝为电解氧化铝,硅酸盐由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水(xMO•nSiO2•mH2O);根据不同类长石其氧原子的物质的量分数相同,结合化合价代数和是0可写出钙长石的化学式;反应符合“多变一”的特征,属于化合反应;符合“一变多”特征的反应,属于分解反应;一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应;有电子的转移的化学反应是氧化还原反应.其特征是有元素化合价变化;
(3)A份中Al、Si与氢氧化钠溶液反应,B份中Al、Mg与盐酸反应,A份和B份中Al反应放出的气体相等,因此两份气体差和质量差均来源于Mg和Si的反应.
解答 解:(1)氧化铁和铝在高温下发生铝热反应生成氧化铝和铁,反应的化学方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,为使反应顺利进行,可加入氯酸钾,为助燃剂,点燃镁时反应放出大量的热,镁为引燃剂,所以引发铝热反应的实验操作是加少量KClO3,插上镁条并将其点燃,
故答案为:铺上一层KClO3粉末,点燃插入的镁条;
(2)地壳中含量排在前五位的元素分别是:O、Si、Al、Fe、Ca,地壳里硅铝的含量硅大于铝;工业上制备金属铝为电解氧化铝,化学方程式为:Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,硅酸盐由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水(xMO•nSiO2•mH2O),钠长石(NaAlSi3O8)的碱性氧化物Na2O、两性氧化物Al2O3、酸性氧化物SiO2,因此钠长石的氧化物形式为:Na2O•Al2O3•6SiO2;结合钠长石的化学式可知钙长石就是将钠长石的中钠更换为钙,以及化合物中化合价代数和等于0可得钙长石,其氧化物形式为:CaO•Al2O3•2SiO2,化学式为CaAl2Si2O8,a.SiO2+2C$\frac{\underline{\;高温\;}}{电炉}$Si(粗)+2CO属于置换反应,属于氧化还原反应,b.SiO2+3C$\frac{\underline{\;高温\;}}{电炉}$SiC+2CO(副反应),
属于氧化还原反应,c.Si(粗)+2C12$\frac{\underline{\;高温\;}}{\;}$SiCl4 属于化合反应,属于氧化还原反应,d.SiC14+2H2$\frac{\underline{\;加热\;}}{\;}$Si+4HC1,属于置换反应,属于氧化还原反应,图“1“区域的反应是复分解反应,属于图“2“区域的反应属于氧化还原反应,图“5、6”““7、8”区域的反应属于化合反应、氧化还原反应,分解反应、氧化还原反应,所以属于图“2“区域的反应是b,
故答案为:>;Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;Na2O•Al2O3•6SiO2;CaAl2Si2O8;b;
(3)A份中Al、Si与氢氧化钠溶液反应,B份中Al、Mg与盐酸反应,A份和B份中Al反应放出的气体相等,因此两份气体差和质量差均来源于Mg、Si,Si、Mg与生成氢气的物质的量关系为:Si~2H2、Mg~H2,标准状况下2240mL气体的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
设A份中含有的Si的物质的量为xmol,B份中含有Mg的物质的量为ymol,
由质量差可得:①24y-28x=1.6
由气体相差0.1mol可得:②2x-y=0.1,
联立求得:x=0.2,y=0.3,则样品中Si和Mg的物质的量分别0.4mol、0.6mol,
故答案为:0.4mol;0.6mol.
点评 本题考查了铝热反应实验、反应类型、硅酸盐的表示方法、有关混合物的计算,题目综合性强,难度中等,熟悉物质的性质是解答本题的关键,有利于培养学生的逻辑思维能力,有助于提升学生的学科素养.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案| A. | (1)(2)(5) | B. | (1)(3)(5) | C. | (1)(4)(5) | D. | (2)(3)(4) |
| A. | C的简单离子还原性大于D | |
| B. | D元素只能以化合态存在于自然界中 | |
| C. | A元素所形成离子的半径有可能大于He原子的半径 | |
| D. | B、D的原子不能相互结合形成化合物 |
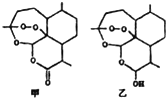 2015年我国药学家屠呦呦因创制青蒿素与双氢青蒿素用于治疗疟疾获得诺贝尔科学奖.图甲为青蒿素分子的结构简式,乙为双氢青蒿素分子的结构简式,其活性结构为分子中的“-O-O-”.下列说法错误的是( )
2015年我国药学家屠呦呦因创制青蒿素与双氢青蒿素用于治疗疟疾获得诺贝尔科学奖.图甲为青蒿素分子的结构简式,乙为双氢青蒿素分子的结构简式,其活性结构为分子中的“-O-O-”.下列说法错误的是( )| A. | 甲分子式为C15H22O5 | |
| B. | 甲、乙分子中均只存在2个六元环 | |
| C. | 甲转化成乙后水溶性增强 | |
| D. | 甲、乙分子中的活性结构“-O-O-”具有强氧化性 |
| A. | 16O2、18O3互为同位素 | |
| B. | 次氯酸的电子式为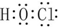 | |
| C. | 氧与氟形成的化合物(OF2)中,氧元素的化合价为-2价 | |
| D. | 一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
| A. | 5 种 | B. | 6 种 | C. | 7 种 | D. | 8 种 |
①H2②铝③CaO④CO2⑤H2SO4 ⑥Ba(OH)2⑦红褐色的氢氧化铁液体⑧氨水⑨稀硝酸⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 |
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++2SO42-,
(4)少量的④通入⑥的溶液中反应的离子方程式为CO2+Ba2++2OH-=BaCO3↓+H2O.
(5)②与⑨发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是1:1,当有5.4gAl发生反应时,转移电子的物质的量为0.6mol.该反应的离子方程式为Al+4H++NO3-=Al3++NO↑+2H2O.
(6)白色沉淀变成灰绿色再变成红褐色沉淀的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
 元素周期表的种类相当多,如大象式、回路式、能级式、亚历山大式等,教材上所附的长式周期表是目前使用最普遍的周期表.有一种非常有趣的商业周期表如图所示.试回答下列问题:
元素周期表的种类相当多,如大象式、回路式、能级式、亚历山大式等,教材上所附的长式周期表是目前使用最普遍的周期表.有一种非常有趣的商业周期表如图所示.试回答下列问题: