题目内容
14. 元素周期表的种类相当多,如大象式、回路式、能级式、亚历山大式等,教材上所附的长式周期表是目前使用最普遍的周期表.有一种非常有趣的商业周期表如图所示.试回答下列问题:
元素周期表的种类相当多,如大象式、回路式、能级式、亚历山大式等,教材上所附的长式周期表是目前使用最普遍的周期表.有一种非常有趣的商业周期表如图所示.试回答下列问题:(1)6:00“时针”所指元素的非金属性比7:00时“时针”所指元素的非金属性弱(填“强”或“弱”).
(2)上述商业周期表所涉及的元素中,最高价氧化物对应水化物的碱性最强的是NaOH(填化学式).
(3)8:05时“时针”和“分针”所指的两种元素(“针”所指以最近为准)形成的化合物所含化学键类型为共价键.
(4)9:00时“时针”和“分针”所指的两种元素形成的化合物M属于离子化合物(填“离子化合物”或“共价化合物”).
分析 (1)6:00“时针”所指元素为C,7:00时“时针”所指元素为N,同周期自左而右元素非金属性增强;
(2)金属性越强,最高价氧化物对应水化物的碱性越强;
(3)8:05时“时针”和“分针”所指的两种元素(“针”所指以最近为准)为O、H,二者形成水与过氧化氢;
(4)9:00时“时针”和“分针”所指的两种元素为F、Mg,二者形成MgF2,属于离子化合物.
解答 解:(1)6:00“时针”所指元素为C,7:00时“时针”所指元素为N,同周期自左而右元素非金属性增强,故非金属性C<N,故答案为:弱;
(2)同周期自左而右金属性减弱、同主族自上而下金属性增强,故上述元素中Na的金属性最强,则NaOH的碱性最强,故答案为:NaOH;
(3)8:05时“时针”和“分针”所指的两种元素(“针”所指以最近为准)为O、H,二者形成水与过氧化氢,含有的化学键为共价键,故答案为:共价键;
(4)9:00时“时针”和“分针”所指的两种元素为F、Mg,二者形成MgF2,属于离子化合物,故答案为:离子化合物.
点评 本题考查元素周期表与元素周期律,注意对元素周期律的理解掌握,熟练掌握元素周期表的结构,注意族与列的关系.

练习册系列答案
相关题目
4.在炼铜的过程中发生:Cu2S+2Cu2O=6Cu+SO2↑,则下列叙述正确的是( )
| A. | 该反应中,氧元素氧化了硫元素 | |
| B. | 该反应从电子转移角度看,每生成6 molCu,转移电子12 mol | |
| C. | 该反应中,Cu2S既是还原剂又是氧化剂 | |
| D. | 该反应从电子转移角度看,与SO2+2H2S=3S↓+2H2 O是同一反应类型 |
3.为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸的浓度和体积;②碱的浓度和体积;③比热容;④反应后溶液的质量;⑤生成水的物质的量;⑥反应前后的温度变化;⑦操作所需时间;( )
①酸的浓度和体积;②碱的浓度和体积;③比热容;④反应后溶液的质量;⑤生成水的物质的量;⑥反应前后的温度变化;⑦操作所需时间;( )
| A. | ③④⑤⑥ | B. | ①③④⑤ | C. | ①②③⑥⑦ | D. | ①②③④⑤⑥ |
7. 美国圣路易斯大学研制了一种新型的乙醇电池,其反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )
美国圣路易斯大学研制了一种新型的乙醇电池,其反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )
 美国圣路易斯大学研制了一种新型的乙醇电池,其反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )
美国圣路易斯大学研制了一种新型的乙醇电池,其反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )| A. | a极为电池的正极 | |
| B. | b极发生氧化反应 | |
| C. | 负极的反应为:4H++O2+4e-═2H2O | |
| D. | 电池工作时,1mol乙醇被氧化时有12mol转移 |
 金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用,利用铝热反应完成钢轨的焊接非常方便迅速.完成下列填空:
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用,利用铝热反应完成钢轨的焊接非常方便迅速.完成下列填空: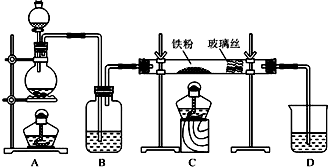

 (R、R′代表烃基)
(R、R′代表烃基)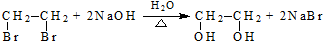 .
. .
. (C10H10O4)的同分异构体中,满足下列条件的有5种.
(C10H10O4)的同分异构体中,满足下列条件的有5种.