题目内容
20.下列说法中不正确的是( )| A. | 浓氨水可检验氯气管道漏气 | |
| B. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| C. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+H2O=SO42-+Cl-+2H+ | |
| D. | 冷的NaOH溶液中通入Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
分析 A、浓氨水挥发出的氨气和氯气发生氧化还原反应生成氮气和氯化铵,反应现象冒白烟;
B、碘是人体必须微量元素,每人每天大约吃食盐12克,多吃无益;
C、次氯酸根离子具有强的氧化性能够氧化亚硫酸根离子;
D、氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
解答 解:A、浓氨水挥发出的氨气和氯气发生氧化还原反应生成氮气和氯化铵,3Cl2+8NH3=N2+6NH4Cl,反应过程中现象是冒白烟,浓氨水可检验氯气管道漏气,故A正确;
B、碘是人体必需微量元素,所以要吃富含KIO3的食盐,但不能多吃,多吃会导致升高血压,促进动脉粥样硬化,故B错误;
C、二氧化硫通入次氯酸钠溶液,反应生成硫酸、氯化钠,反应的离子方程式为:SO2+ClO-+H2O=SO42-+Cl-+2H+,故C正确
D、氯气与氢氧化钠溶液反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故D正确;
故选B.
点评 本题考查了离子方程式的正误判断,明确电离方程式的书写注意问题及弱电解质的判断即可解答,题目较简单.

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
10.“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.相关数据如表:
请回答:①c1=c2(填“>”、“<”或“=”);a=19.6.
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol/(L•s).
(2)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n (NO):n(CO)=1:2的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母).

(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.相关数据如表:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol/(L•s).
(2)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n (NO):n(CO)=1:2的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母).

11.一个固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g)?3C(g)+D(s),达到平衡时,C的浓度为ω mol/L.若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是( )
| A. | 4 mol A+2 mol B | B. | 3 mol C+2 mol D | ||
| C. | 1 mol B+3 mol C+1 mol D | D. | 2 mol A+1 mol B+3mol C+1 mol D |
15.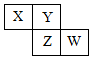 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
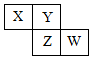 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )| A. | Y单质与氢气反应较Z剧烈 | |
| B. | 最高价氧化物对应水化物酸性W比Z弱 | |
| C. | X单质氧化性强于Y单质 | |
| D. | X与W的原子核外电子数相差9 |
5.实验中的下列操作正确的是( )
| A. | 进行蒸馏操作时冷凝管进水的方向是上进下出 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
12.对醋酸的电离平衡不产生影响的微粒是( )
| A. |  | B. | HBr | C. |  | D. | HCHHCOO- |
9.下列有关反应限度的叙述正确的是( )
| A. | 当温度一定时,不同的起始条件下可逆反应建立平衡状态时,平衡常数和转化率一定是定值 | |
| B. | 依据焓判据:NH4HCO3受热分解可自发进行 | |
| C. | 大多数化学反应在一定条件下都有一定的限度 | |
| D. | FeCl3与KSCN反应达到平衡时,向其中滴加少量KCl溶液,则溶液颜色变深 |
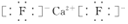 ;Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O.
;Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O.