题目内容
8.已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成2mol NH3的反应热是△H=-92kJ•mol-1,该反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.分析 化学反应中,化学键断裂吸收能量,形成新化学键放出能量,焓变等于断键吸收的能量减去成键释放的能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答 解:在反应N2+3H2?2NH3中,断裂3molH-H键、1mol N三N键共吸收的能量为3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为2346kJ-2254kJ=92kJ,即N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,N2与H2反应生成2mol NH3的反应热是△H=-92kJ•mol-1,
故答案为:△H=-92kJ•mol-1;N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
点评 本题考查热化学方程式,为高频考点,把握热化学方程式的书写、焓变与键能的关系为解答的关键,侧重分析与应用能力的考查,注意焓变的计算方法,题目难度不大.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
18.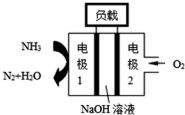 (1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
aA (g)+bB (g)?2C(g)
则:①该可逆反应的化学方程式可表示为3A(g)+B(g)?2C(g);
②0到2s用物质B来表示的反应速率为0.1mol/(L•s);
③从反应开始到2s末,A的转化率为40%;
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是BE.
A.vB(反应)=vC(生成) B.容器内气体的总压强保持不变
C.容器内气体的密度不变 D.vA:vB:vC=3:2:2
E.容器内气体C的物质的量分数保持不变
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO.则该电池的负极材料是锌;
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,该燃料电池工作时,电池的总反应为4NH3+3O2=2N2+6H2O;负极的电极反应为2NH3-6e-+6OH-═N2+6H2O.
 (1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:aA (g)+bB (g)?2C(g)
| 起始物质的量浓度(mol/L) | 1.5 | 1 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
②0到2s用物质B来表示的反应速率为0.1mol/(L•s);
③从反应开始到2s末,A的转化率为40%;
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是BE.
A.vB(反应)=vC(生成) B.容器内气体的总压强保持不变
C.容器内气体的密度不变 D.vA:vB:vC=3:2:2
E.容器内气体C的物质的量分数保持不变
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO.则该电池的负极材料是锌;
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,该燃料电池工作时,电池的总反应为4NH3+3O2=2N2+6H2O;负极的电极反应为2NH3-6e-+6OH-═N2+6H2O.
16.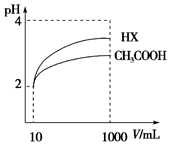 25℃时,电离平衡常数:
25℃时,电离平衡常数:
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(2)下列反应不能发生的是:cd;
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+HClO=CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是B;
A.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ B.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ C.$\frac{c({H}^{+})}{{K}_{W}}$ D.$\frac{c({H}^{+})}{c(O{H}^{-})}$
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)
(5)某温度下,纯水中c (H+)=2.0×10-7mol•L-1,0.9mol•L-1NaOH溶液与0.1mol•L-1HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=13.
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(2)下列反应不能发生的是:cd;
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+HClO=CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是B;
A.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ B.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ C.$\frac{c({H}^{+})}{{K}_{W}}$ D.$\frac{c({H}^{+})}{c(O{H}^{-})}$
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)
(5)某温度下,纯水中c (H+)=2.0×10-7mol•L-1,0.9mol•L-1NaOH溶液与0.1mol•L-1HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=13.
13.下列实验“操作”、“现象”与“结论”对应关系正确的是( )
| 选 项 | 操 作 | 现 象 | 结 论 |
| A | 向无水乙醇中滴入酸性KMnO4溶液,充分振荡 | 紫红色褪去 | 乙醇有氧化性 |
| B | 向某溶液中滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
| C | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
20.下列说法中不正确的是( )
| A. | 浓氨水可检验氯气管道漏气 | |
| B. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| C. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+H2O=SO42-+Cl-+2H+ | |
| D. | 冷的NaOH溶液中通入Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
18.在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命.表是500mL“鲜花保鲜剂”中含有的成分,阅读并回答下列问题:
(1)下列“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为0.024mol/L(要求:用原始数据写出表达式即可,不需要化简与计算)
(2)配制上述“鲜花保鲜剂”所的仪器有烧杯、玻璃棒、药匙、托盘天平(带砝码)、500mL容量瓶、胶头滴管(填所缺仪器的名称).
(3)在溶液配制过程中,下列操作对配制结果没有影响的是BD.
A.定容时,俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)若要配制0.5mol/L 500mL的硫酸溶液,则:
①所需质量分数为98%、密度为1.84g.cm-3的浓硫酸的体积为13.6(计算结果保留一位小数)mL;
②如果实验室有15mL、20mL、50mL量筒,应选用15mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸稀释,稀释时操作方法是将浓硫酸沿烧杯壁注入水中并用玻 璃棒不断搅拌.
| 成分 | 成分的质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.02 | 170 |
(2)配制上述“鲜花保鲜剂”所的仪器有烧杯、玻璃棒、药匙、托盘天平(带砝码)、500mL容量瓶、胶头滴管(填所缺仪器的名称).
(3)在溶液配制过程中,下列操作对配制结果没有影响的是BD.
A.定容时,俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)若要配制0.5mol/L 500mL的硫酸溶液,则:
①所需质量分数为98%、密度为1.84g.cm-3的浓硫酸的体积为13.6(计算结果保留一位小数)mL;
②如果实验室有15mL、20mL、50mL量筒,应选用15mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸稀释,稀释时操作方法是将浓硫酸沿烧杯壁注入水中并用玻 璃棒不断搅拌.