题目内容
11.一个固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g)?3C(g)+D(s),达到平衡时,C的浓度为ω mol/L.若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是( )| A. | 4 mol A+2 mol B | B. | 3 mol C+2 mol D | ||
| C. | 1 mol B+3 mol C+1 mol D | D. | 2 mol A+1 mol B+3mol C+1 mol D |
分析 反应2A(g)+B(g)?3C(g)+D(s),D为固体,D的量不影响平衡;在恒温恒容下,不同途径达到平衡后,C的浓度仍为ωmol/L,说明与原平衡为等效平衡,按化学计量数转化到方程式的左边,只要满足n(A)=2mol,n(B)=1mol即可,据此进行分析.
解答 解:A、该反应是气体体积不变的反应,压强不影响平衡,开始加入4molA+2molB,与加入2molA和1molB达平衡的平衡为等效平衡,达到平衡时C的浓度为2ωmol/L,故A错误;
B、开始加入3molC+2molD,则先将3molC、1molD按化学计量数转化到左边可得2molA、1molB,故等效为开始加入2molA、1molB所到达的平衡,达到平衡时C的浓度为ω mol/L,再多加1molD是固体,不会引起平衡的移动,故B正确;
C、1molB+3molC+1molD,按化学计量数转化到左边可得2molA、2molB,与原反应不是等效平衡,达到平衡时C的浓度为不是ω mol/L,故C错误;
D、2molA+1molB+3molC+1molD,按方程式的化学计量数转化到左边,可得4molA、2molB与原反应成比例等效平衡,达到平衡时C的浓度为2ω mol/L,故D错误;
故选:B.
点评 考查化学平衡的有关计算、等效平衡,难度中等,构建平衡建立的途径是解题关键,注意等效平衡规律:1、恒温恒压下,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡;2、恒温恒容下,若反应前后气体气体发生变化,按化学计量数转化到一边,满足对应物质的物质的量相等,为等效平衡;若反应前后气体的体积不变,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡.

练习册系列答案
相关题目
1.氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)已知:H-H键能为436kJ•mol-1,N≡N键能为945kJ•mol-1,N-H键能为391kJ?mol-1.写出合成氨反应的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-93kJ•mol-1.
(2)恒温下,往一个2L的密闭容器中充入2.6mol H2和1mol N2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
5min内,消耗N2的平均反应速率为0.008mol•L-1•min-1,此条件下该反应的化学平衡常数K=0.1[或0.1(mol•L-1)-2];反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,化学平衡将向逆反应方向移动(填“正反应”或“逆反应”).
(1)已知:H-H键能为436kJ•mol-1,N≡N键能为945kJ•mol-1,N-H键能为391kJ?mol-1.写出合成氨反应的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-93kJ•mol-1.
(2)恒温下,往一个2L的密闭容器中充入2.6mol H2和1mol N2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
2.要从含Al3+、Fe3+、Ba2+、Ag+的溶液中分别一一沉淀出Fe3+、Ba2+、Ag+,加入试剂的顺序正确的是( )
| A. | HCl、H2SO4、NH3•H2O | B. | NaOH、HCl、H2SO4 | ||
| C. | HCl、H2SO4、NaOH | D. | HCl、NaOH、H2SO4 |
16. 25℃时,电离平衡常数:
25℃时,电离平衡常数:
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(2)下列反应不能发生的是:cd;
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+HClO=CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是B;
A.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ B.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ C.$\frac{c({H}^{+})}{{K}_{W}}$ D.$\frac{c({H}^{+})}{c(O{H}^{-})}$
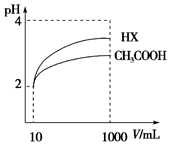
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)
(5)某温度下,纯水中c (H+)=2.0×10-7mol•L-1,0.9mol•L-1NaOH溶液与0.1mol•L-1HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=13.
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(2)下列反应不能发生的是:cd;
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+HClO=CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是B;
A.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ B.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ C.$\frac{c({H}^{+})}{{K}_{W}}$ D.$\frac{c({H}^{+})}{c(O{H}^{-})}$
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)
(5)某温度下,纯水中c (H+)=2.0×10-7mol•L-1,0.9mol•L-1NaOH溶液与0.1mol•L-1HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=13.
20.下列说法中不正确的是( )
| A. | 浓氨水可检验氯气管道漏气 | |
| B. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| C. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+H2O=SO42-+Cl-+2H+ | |
| D. | 冷的NaOH溶液中通入Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
1.下列离子方程式改写成化学方程式正确的是( )
| A. | Mg2++2OH-═Mg(OH)2↓ Mg(NO3)2+Ba(OH)2═Mg(OH)2↓+Ba(NO3)2 | |
| B. | Fe+Cu2+═Fe2++Cu Fe+CuO═FeO+Cu | |
| C. | Ag++Cl-═AgCl↓ Ag2SO4+2HCl═2AgCl↓+H2SO4 | |
| D. | CO2+2OH-═CO32-+H2O CO2+2NH3•H2O═(NH4)2CO3+H2O |
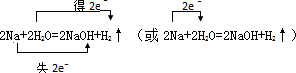 .反应中若产生0.2mol的气体,则有0.4mol的电子转移.
.反应中若产生0.2mol的气体,则有0.4mol的电子转移.