题目内容
10.“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.相关数据如表:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol/(L•s).
(2)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n (NO):n(CO)=1:2的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母).

分析 (1)①应用恒温恒容条件下的等效平衡知识来解决;甲、乙是等效平衡,则甲中放出的热量与乙中吸收的热量之和为49.0kJ;
②平衡时能量变化放出29.4kJ,求反应消耗的二氧化碳的物质的量,然后根据v=$\frac{△c}{△t}$计算平均反应速率;
(2)a.平衡常数与温度有关,温度不变,则平衡常数始终不变;
b.t1时刻CO与二氧化碳物质的量相等,t1时刻后二者物质的量仍然继续变化;
c.起始通入n(NO):n(CO)=1:2,二者反应按1:1进行,随反应进行比例关系发生变化,从t1时刻起n(CO):n(NO)不再变化,说明到达平衡;
d.到达平衡时,反应物的转化率不变.
解答 解:(1)①应用恒温恒容条件下的乙的投料量极端转化为甲相当于投1mol CO2(g)和3mol H2(g),所以两者是等效平衡,所以c1=c2,甲、乙是等效平衡,则甲中放出的热量与乙中吸收的热量之和为49.0kJ,则a=49.0kJ-29.4kJ=19.6kJ,
故答案为:=;19.6;
②平衡时能量变化放出29.4kJ,所以反应二氧化碳的物质的量为$\frac{29.4kJ}{49.0kJ}$=0.6mol,所以,然后求平均反应速率v=$\frac{△c}{△t}$=$\frac{\frac{0.6mol}{2L}}{10s}$=0.03mol/(L•min),
故答案为:0.03;
(2)当反应前后改变的物理量不变时,该可逆反应达到平衡状态,
a中为平衡常数,平衡常数与温度有关,温度不变,则平衡常数始终不变,所以平衡常数不能判断是否达到平衡状态,故a错误;
b为物质的量随时间的变化,一氧化氮与二氧化碳物质的量相等时,各组分的量仍然继续变化,说明没有达到平衡状态,故b错误;
c起始通入n(NO):n(CO)=1:2,二者反应按1:1进行,随反应进行比例关系发生变化,从t1时刻起n(CO):n(NO)不再变化,说明到达平衡,故c正确;
d、反应物的转化率不变,说明达平衡状态,故d正确;
故答案为:cd.
点评 本题考查化学平衡的有关计算、等效平衡、化学平衡状态判断等,(1)中关键是对等效平衡规律的理解掌握,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7米之间 | |
| B. | 分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应 | |
| C. | 往FeCl3溶液中加入NaOH溶液,并适当加热,可制得Fe(OH)3胶体 | |
| D. | 三种分散系中分散质均属于电解质 |
(1)已知:H-H键能为436kJ•mol-1,N≡N键能为945kJ•mol-1,N-H键能为391kJ?mol-1.写出合成氨反应的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-93kJ•mol-1.
(2)恒温下,往一个2L的密闭容器中充入2.6mol H2和1mol N2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 (1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:aA (g)+bB (g)?2C(g)
| 起始物质的量浓度(mol/L) | 1.5 | 1 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
②0到2s用物质B来表示的反应速率为0.1mol/(L•s);
③从反应开始到2s末,A的转化率为40%;
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是BE.
A.vB(反应)=vC(生成) B.容器内气体的总压强保持不变
C.容器内气体的密度不变 D.vA:vB:vC=3:2:2
E.容器内气体C的物质的量分数保持不变
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO.则该电池的负极材料是锌;
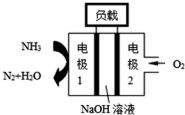
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,该燃料电池工作时,电池的总反应为4NH3+3O2=2N2+6H2O;负极的电极反应为2NH3-6e-+6OH-═N2+6H2O.
| 实验序号 | 温度 | 0min | 10min | 20min | 30min | 40min | 50min | 60min |
| 1 | 820℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 820℃ | c1 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 800℃ | 1.0 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1中,反应在10min至20min时间内平均速率v(A)为0.013mol/(L•min);达到平衡时A的转化率是50%,B的浓度是0.25mol/L;800℃时,该反应2A(g)?B(g)+D(g) 的平衡常数数值是0.25;若同温下,另一个恒容密闭的容器中也在发生该反应,某时刻A、B、D的浓度均为2mol/L,则该时刻v(正)<v(逆)(填“>”“=”或“<”).
(2)在实验2中,A的初始浓度c1=1.0mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是使用了催化剂.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3<v1(填“>”“=”或“<”),且c2> 1.0mol/L (填“>”“=”或“<”).
(4)比较实验4和实验1,可推测该反应是放热反应(填“吸热”或“放热”).
| A. | 0.045 mol/L | B. | 1 mol/L | C. | 0.5 mol/L | D. | 2.24mol/L |
| A. | HCl、H2SO4、NH3•H2O | B. | NaOH、HCl、H2SO4 | ||
| C. | HCl、H2SO4、NaOH | D. | HCl、NaOH、H2SO4 |
| A. | 浓氨水可检验氯气管道漏气 | |
| B. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| C. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+H2O=SO42-+Cl-+2H+ | |
| D. | 冷的NaOH溶液中通入Cl2:Cl2+2OH-═Cl-+ClO-+H2O |