题目内容
19.某气态烃0.2mol最多和0.4mol氢气发生加成反应,所得产物又能与2mol氯气发生取代反应,最后得到一种只含碳、氯元素的化合物,则原气态烃为( )| A. | 1-丁炔 | B. | 丙烯 | C. | 丙炔 | D. | 2-戊炔 |
分析 同一条件下,参加反应的气体体积之比=物质的量之比,某气态烃0.2mol最多和0.4mol氢气发生加成反应,生成0.2mol氯代烷,则1mol该气态烃最多和2mol氢气发生加成反应,说明分子中含有1个C≡C或2个C=C键;所得0.2mol产物又能与2mol氯气发生取代反应,则1mol该产物与氯气反应最多消耗10mol氯气,说明加成产物中含有10个H原子,则该气态烃应含有6个H原子,由此可确定烃的种类.
解答 解:某气态烃0.2mol最多和0.4mol氢气发生加成反应,生成0.2mol氯代烷,则1mol该气态烃l最多和2mol氢气发生加成反应,说明分子中含有1个C≡C或2个C=C键,所得0.2mol产物又能与2mol氯气发生取代反应,则1mol该产物与氯气反应最多消耗$\frac{1mol}{0.2mol}$×2mol=10mol氯气,说明加成产物中含有10个H原子,则原气态烃应含有6个H原子,
根据分析可知,该气态烃可能为炔烃或二烯烃,故B错误;
结合分子中含有6个H原子可知满足条件的炔烃为丁炔,故A正确,C、D错误
故选A.
点评 本题考查有机物分子式确定的计算,题目难度中等,正确判断分子中官能团的和H原子数目为解答关键,注意掌握常见有机物结构与性质,试题培养了学生的化学计算能力.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
9.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2 L的苯所含的分子个数为0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含原子个数为2.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子个数为3NA |
7.PCl3可用于半导体生产的外延、扩散工序.有关物质的部分性质如下:
(一)制备:如图是实验室制备PCl3的装置(部分仪器已省略)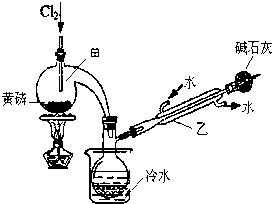
(1)仪器乙的名称冷凝管.
(2)实验室用漂白粉加浓盐酸制备Cl2的化学方程式:Ca(ClO)2+4HCl═CaCl2+2H2O+2Cl2↑.
(3)碱石灰的作用是吸收多余的Cl2,防止污染环境,且防止空气中的水分进入,影响产品纯度.
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间的CO2,其目的是排尽装置中的空气,防止O2和水与PCl3反应.
(二)提纯:
(5)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到PCl3的纯品.
| 熔点/℃ | 沸点/℃ | 密度/g•mL-1 | 其他 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |

(1)仪器乙的名称冷凝管.
(2)实验室用漂白粉加浓盐酸制备Cl2的化学方程式:Ca(ClO)2+4HCl═CaCl2+2H2O+2Cl2↑.
(3)碱石灰的作用是吸收多余的Cl2,防止污染环境,且防止空气中的水分进入,影响产品纯度.
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间的CO2,其目的是排尽装置中的空气,防止O2和水与PCl3反应.
(二)提纯:
(5)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到PCl3的纯品.
14.下列有机物的命名正确的是( )
| A. | 二溴乙烷: | B. | 3-乙基-1-丁烯: | ||
| C. | 2-甲基-2,4-己二烯: | D. | 2,2,3-三甲基戊烷: |
4.常温常压下,下列各组物质的物理性质排列不正确的是( )
| A. | 密度:四氯化碳>乙酸乙酯>水 | |
| B. | 沸点:乙醇>丙烷>乙烷 | |
| C. | 在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| D. | 熔点:对二甲苯>邻二甲苯>间二甲苯 |
11.在一定温度下的定容容器中,发生反应:2A(g)+B(s)?C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①混合气体的压强不变
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④C(g)的物质的量浓度不变
⑤容器内A、C、D三种气体的浓度之比为2:1:1
⑥单位时间内生成n molD,同时生成2n mol A
⑦单位时间内生成n molC,同时消耗n mol D.
①混合气体的压强不变
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④C(g)的物质的量浓度不变
⑤容器内A、C、D三种气体的浓度之比为2:1:1
⑥单位时间内生成n molD,同时生成2n mol A
⑦单位时间内生成n molC,同时消耗n mol D.
| A. | ①②③ | B. | ②③④⑥ | C. | ②③⑤⑥⑦ | D. | ①③⑤⑦ |
9.将铜棒和锌棒用导线连接后插入稀硫酸溶液中,下列叙述中正确的是( )
| A. | 该装置能形成原电池,其中锌是负极 | |
| B. | 该装置能形成原电池,其中铜是负极 | |
| C. | 该装置不能形成原电池 | |
| D. | 以上说法均不正确 |