题目内容
14.下列有机物的命名正确的是( )| A. | 二溴乙烷: | B. | 3-乙基-1-丁烯: | ||
| C. | 2-甲基-2,4-己二烯: | D. | 2,2,3-三甲基戊烷: |
分析 A.未指明官能团的位置;
B.含有官能团的最长碳链为5个碳;
C.含有碳碳双键的最长碳链为6个碳,官能团同近时考虑支链位次和小;
D.甲基的位次错误,应该为2、2、4号碳上.
解答 解:A. 命名为1,2-二溴乙烷,故A错误;
命名为1,2-二溴乙烷,故A错误;
B. ,命名为3-甲基-1-戊烯,故B错误;
,命名为3-甲基-1-戊烯,故B错误;
C.含有碳碳双键的最长碳链为6个碳,官能团同近时考虑支链位次和小, 命名为2-甲基-2,4-己二烯,故C正确;
命名为2-甲基-2,4-己二烯,故C正确;
D.甲基的位次错误,应该为2、2、4号碳上, 命名为2,2,4-三甲基戊烷,故D错误;
命名为2,2,4-三甲基戊烷,故D错误;
故选C.
点评 本题考查了烷烃、烯烃、卤代烃的命名,难度不大,掌握常见有机物的系统命名规则是解题的关键.

练习册系列答案
相关题目
5.可逆反应H2(g)+I2(g)═2HI(g)达到平衡时的标志是( )
| A. | 混合气体密度恒定不变 | |
| B. | 混合气体的颜色不再改变 | |
| C. | H2、I2、HI的浓度相等 | |
| D. | H2、I2、HI在混合气体中体积分数相等 |
2.在下列各组离子中,能大量共存的( )
| A. | Ag+、NO3-、Na+、Cl- | B. | K+、HCO3-、Cl-、Al3+ | ||
| C. | NO3-、Fe2+、H+、Br- | D. | K+、Cl-、SO42-、NH4+ |
19.某气态烃0.2mol最多和0.4mol氢气发生加成反应,所得产物又能与2mol氯气发生取代反应,最后得到一种只含碳、氯元素的化合物,则原气态烃为( )
| A. | 1-丁炔 | B. | 丙烯 | C. | 丙炔 | D. | 2-戊炔 |
6.下列说法正确的是(NA为阿伏加德罗常数)( )
| A. | 1molP4含有P-P键的个数为4NA | |
| B. | 1 mol Na2O2晶体中含有阴阳离子总数为4NA | |
| C. | 1mol金刚石中含有C-C键的个数为2NA | |
| D. | 1molSiO2中含Si-O键的个数为2NA |
3.对于化学反应方向的确定,下列说法正确的是( )
| A. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 | |
| B. | 温度、压强一定时,放热的熵增加的反应不一定能自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 能够自发进行的反应就一定能够发生并完成 |
4.表是元素周期表的一部分,针对a~K十一种元素回答下列问题(请用具体化学式回答)
(1)这些元素中非金属性最强的单质是F2,最高价氧化物对应水化物酸性最强的是HClO4,最高价氧化物对应水化物碱性最强是NaOH.
(2)表中K的氢化物的化学式为H2S,它的还原性比j的氢化物还原性强(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性弱(填“强”或“弱”).
(3)e单质的电子式为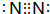 ,e的氢化物的结构式为
,e的氢化物的结构式为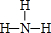 .
.
(4)用电子式表示h与k构成化合物的形成过程
(5)写出i的氧化物与强碱反应的离子方程式Al2O3+2OH-=2AlO2-+H2O
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热.将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应.下列说法正确的是AD(填写选项).
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |
(2)表中K的氢化物的化学式为H2S,它的还原性比j的氢化物还原性强(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性弱(填“强”或“弱”).
(3)e单质的电子式为
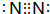 ,e的氢化物的结构式为
,e的氢化物的结构式为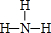 .
.(4)用电子式表示h与k构成化合物的形成过程

(5)写出i的氧化物与强碱反应的离子方程式Al2O3+2OH-=2AlO2-+H2O
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热.将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应.下列说法正确的是AD(填写选项).
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡.
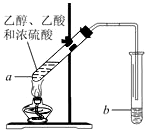 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热.
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O; ;
;