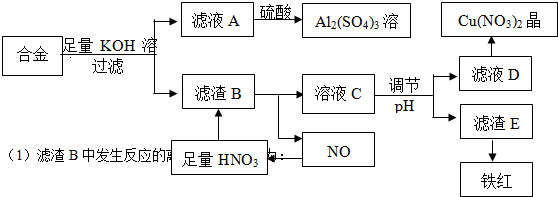
题目内容
4.常温常压下,下列各组物质的物理性质排列不正确的是( )| A. | 密度:四氯化碳>乙酸乙酯>水 | |
| B. | 沸点:乙醇>丙烷>乙烷 | |
| C. | 在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| D. | 熔点:对二甲苯>邻二甲苯>间二甲苯 |
分析 A.卤代烃密度大于水,酯的密度小于水;
B.含有氢键的物质熔沸点较高,分子晶体熔沸点与相对分子质量成正比;
C.含-OH越多,溶解性越大,卤代烃不溶于水;
D.二甲苯中,结构越对称,其熔沸点越高.
解答 解:A.卤代烃密度大于水,酯的密度小于水,所以密度四氯化碳>水>乙酸乙酯,故A错误;
B.含有氢键的物质熔沸点较高,分子晶体熔沸点与相对分子质量成正比,乙醇中含有氢键,熔沸点最高,丙烷相对分子质量大于乙烷且二者都是分子晶体,所以熔沸点:乙醇>丙烷>乙烷,故B正确;
C.含-OH越多,溶解性越大,卤代烃不溶于水,则室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷,故C正确;
D.对二甲苯>间二甲苯>邻二甲苯对称性依次减弱,依据称性越好沸点越低,沸点顺序为:对二甲苯<间二甲苯<邻二甲苯,故D正确;故选A.
点评 本题考查物质溶解度、熔沸点、密度大小比较,明确分子晶体熔沸点与溶解性的影响因素是解本题关键,注意溶解性与-OH的关系,易错选项是C.

练习册系列答案
相关题目
15.下列物质的类别与所含官能团的书写都正确的是( )
| A. |  酚类-OH 酚类-OH | B. |  羧酸-CHO 羧酸-CHO | ||
| C. | CH3CH=CHCH=CH2 烯烃 C=C | D. | CH3-O-CH3 醚类 |
12.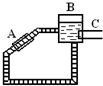 太阳能的开发和利用是21世纪的一个重要课题.
太阳能的开发和利用是21世纪的一个重要课题.
①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节.已知下列数据:
其中最适宜作储能介质的是B(填字母).
A、CaCl2•6H2O B、Na2SO4•10H2O C、Na2HPO4•12H2O D、Na2S2O3•5H2O
②如图是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器.根据
对水的密度的认识,你估计在阳光照射下水将沿顺(填“顺”或“逆”)时针方向流动.
 太阳能的开发和利用是21世纪的一个重要课题.
太阳能的开发和利用是21世纪的一个重要课题.①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节.已知下列数据:
| 盐 | 熔点/℃ | 熔化吸热/KJ•mol-1 | 参考价格/元•kg-1 |
| CaCl2•6H2O | 29.0 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 36.1 | 100.1 | 1600~2000 |
| Na2S2O3•5H2O | 48.5 | 49.7 | 1400~1800 |
A、CaCl2•6H2O B、Na2SO4•10H2O C、Na2HPO4•12H2O D、Na2S2O3•5H2O
②如图是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器.根据
对水的密度的认识,你估计在阳光照射下水将沿顺(填“顺”或“逆”)时针方向流动.
19.某气态烃0.2mol最多和0.4mol氢气发生加成反应,所得产物又能与2mol氯气发生取代反应,最后得到一种只含碳、氯元素的化合物,则原气态烃为( )
| A. | 1-丁炔 | B. | 丙烯 | C. | 丙炔 | D. | 2-戊炔 |
9.A、B、C、D四块金属片,进行如下实验:
①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;
②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由C经导线流向D;
③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;
④B、D相连后,同时浸入稀H2SO4溶液中,B极发生氧化反应.
据此,判断四种金属的活动性顺序是( )
①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;
②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由C经导线流向D;
③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;
④B、D相连后,同时浸入稀H2SO4溶液中,B极发生氧化反应.
据此,判断四种金属的活动性顺序是( )
| A. | A>B>D>C | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
16.下列有关叙述正确的是( )
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O中子数相同,质子数不同,互为同位素 | |
| B. | ${\;}_{9}^{19}$F-微粒质量数为19,电子数为9 | |
| C. | Na2O2晶体中阳离子与阴离子个数比为2:1 | |
| D. | MgCl2晶体中存在既存在离子键又存在共价键 |
13.W是由短周期元素X、Y、Z组成的盐.X、Y、Z原子的最外层电子数依次增大,Z原子最外层电子数是内层电子数的3倍;X、Y原子最外层电子数之和等于Z原子的最外层电子数;Y、Z同周期且相邻,但与X 不同周期.下列说法一定正确的是( )
| A. | 三种元素的最高正化合价中,Z的最大 | |
| B. | X、Y、Z不能形成共价化合物 | |
| C. | 原子半径:X>Y>Z | |
| D. | Y的最高价氧化物对应的水化物是强酸 |
14.用下列装置完成相关实验,不合理的是( )
| A. |  用a趁热过滤提纯苯甲酸 | B. |  用b制备并检验乙烯 | ||
| C. |  用c制无水乙醇 | D. |  用d分离硝基苯与水 |