题目内容
8.向物质的两浓度均为0.01mol•L-1的FeCl2和MnCl2混合溶液中,滴加Na2S溶液,先沉淀的是Fe2+(填离子符号);当MnS开始沉淀时,溶液中$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$为2×105.(Ksp(MnS)=4.64×10-14,Ksp(FeS)=2.32×10-19)
分析 结合沉淀类型及Ksp可知,Ksp小的先沉淀,当MnS开始沉淀时,硫离子相同,则溶液中$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$=$\frac{Ksp(MnS)}{Ksp(FeS)}$,以此来解答.
解答 解:由Ksp(MnS)=4.64×10-14,Ksp(FeS)=2.32×10-19可知,Ksp(FeS)小,则浓度均为0.01mol•L-1的FeCl2和MnCl2混合溶液中,滴加Na2S溶液,先沉淀的是Fe2+,当MnS开始沉淀时,硫离子相同,则溶液中$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$=$\frac{Ksp(MnS)}{Ksp(FeS)}$=$\frac{4.64×1{0}^{-14}}{2.32×1{0}^{-19}}$=2×105,
故答案为:Fe2+;2×105.
点评 本题考查难溶电解质的计算,为高频考点,把握Ksp的关系及计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
18.下列有机分子中,所有的原子不可能处于同一平面的是( )
| A. | CH3-CH2-C≡CH | B. | CH2=CH-CH=CH2 | C. |  | D. |  |
19.某气态烃0.2mol最多和0.4mol氢气发生加成反应,所得产物又能与2mol氯气发生取代反应,最后得到一种只含碳、氯元素的化合物,则原气态烃为( )
| A. | 1-丁炔 | B. | 丙烯 | C. | 丙炔 | D. | 2-戊炔 |
16.下列有关叙述正确的是( )
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O中子数相同,质子数不同,互为同位素 | |
| B. | ${\;}_{9}^{19}$F-微粒质量数为19,电子数为9 | |
| C. | Na2O2晶体中阳离子与阴离子个数比为2:1 | |
| D. | MgCl2晶体中存在既存在离子键又存在共价键 |
3.对于化学反应方向的确定,下列说法正确的是( )
| A. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 | |
| B. | 温度、压强一定时,放热的熵增加的反应不一定能自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 能够自发进行的反应就一定能够发生并完成 |
13.W是由短周期元素X、Y、Z组成的盐.X、Y、Z原子的最外层电子数依次增大,Z原子最外层电子数是内层电子数的3倍;X、Y原子最外层电子数之和等于Z原子的最外层电子数;Y、Z同周期且相邻,但与X 不同周期.下列说法一定正确的是( )
| A. | 三种元素的最高正化合价中,Z的最大 | |
| B. | X、Y、Z不能形成共价化合物 | |
| C. | 原子半径:X>Y>Z | |
| D. | Y的最高价氧化物对应的水化物是强酸 |
20.下列说法正确的是( )
| A. | 改变条件使平衡正移,反应物的转化率一定增大 | |
| B. | pH=1的醋酸加水稀释,溶液中各离子浓度都减小 | |
| C. | 合成氨反应等温压缩,重新建立平衡时各组分浓度都增大 | |
| D. | pH均为2的盐酸和醋酸分别加水稀释至原来的10倍,水的电离程度相等 |
17.下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
| A. | 硫化氢在氧气中燃烧 | B. | 铁在硫蒸气中燃烧 | ||
| C. | 二氧化硫通入石灰水 | D. | 锌粉和硫酸反应 |
18.下列化学用语正确的是( )
| A. | 2-丙醇的结构式:CH3CHOHCH3 | |
| B. | 丙烯分子的结构简式为 CH3CH CH 2 | |
| C. | 四氯化碳分子的电子式为: | |
| D. | 2-乙基-1,3-丁二烯的键线式: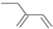 |