题目内容
11.在一定温度下的定容容器中,发生反应:2A(g)+B(s)?C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )①混合气体的压强不变
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④C(g)的物质的量浓度不变
⑤容器内A、C、D三种气体的浓度之比为2:1:1
⑥单位时间内生成n molD,同时生成2n mol A
⑦单位时间内生成n molC,同时消耗n mol D.
| A. | ①②③ | B. | ②③④⑥ | C. | ②③⑤⑥⑦ | D. | ①③⑤⑦ |
分析 化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答 解:①反应前后气体的体积不变,故混合气体的压强不变不能作为判断是否达到化学平衡状态的依据,故错误;
②密度=$\frac{m}{V}$,总质量再变,体积不变,故密度会变,故混合气体的密度不变可作为判断是否达到化学平衡状态的依据,故正确;
③混合气体的平均相对分子质量等于质量和物质的量的比,质量变,物质的量不变,所以混合气体的平均相对分子质量变,即混合气体的平均相对分子质量不变一定平衡,故正确;
④C(g)的物质的量浓度不变可作为判断是否达到化学平衡状态的依据,故正确;
⑤平衡时各物质的物质的量之比取决于物质的起始物质的量和转化率,故容器内A、C、D三种气体的浓度之比为2:1:1不能作为判断是否达到平衡状态的依据,故④错误;
⑥生成nmolD是正反应,同时生成2nmolA是逆反应,且化学反应速率之比等于化学计量数之比,故正逆反应速率相等,故正确;
⑦生成nmolC是正反应,同时生成nmolD也是正反应,故错误;
故能表明反应已达到平衡状态的是②④③⑥,
故选B.
点评 本题考查化学平衡状态的判断,题目难度不大.要注意把握平衡状态的特征.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
2.在下列各组离子中,能大量共存的( )
| A. | Ag+、NO3-、Na+、Cl- | B. | K+、HCO3-、Cl-、Al3+ | ||
| C. | NO3-、Fe2+、H+、Br- | D. | K+、Cl-、SO42-、NH4+ |
19.某气态烃0.2mol最多和0.4mol氢气发生加成反应,所得产物又能与2mol氯气发生取代反应,最后得到一种只含碳、氯元素的化合物,则原气态烃为( )
| A. | 1-丁炔 | B. | 丙烯 | C. | 丙炔 | D. | 2-戊炔 |
6.下列说法正确的是(NA为阿伏加德罗常数)( )
| A. | 1molP4含有P-P键的个数为4NA | |
| B. | 1 mol Na2O2晶体中含有阴阳离子总数为4NA | |
| C. | 1mol金刚石中含有C-C键的个数为2NA | |
| D. | 1molSiO2中含Si-O键的个数为2NA |
16.下列有关叙述正确的是( )
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O中子数相同,质子数不同,互为同位素 | |
| B. | ${\;}_{9}^{19}$F-微粒质量数为19,电子数为9 | |
| C. | Na2O2晶体中阳离子与阴离子个数比为2:1 | |
| D. | MgCl2晶体中存在既存在离子键又存在共价键 |
3.对于化学反应方向的确定,下列说法正确的是( )
| A. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 | |
| B. | 温度、压强一定时,放热的熵增加的反应不一定能自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 能够自发进行的反应就一定能够发生并完成 |
20.下列说法正确的是( )
| A. | 改变条件使平衡正移,反应物的转化率一定增大 | |
| B. | pH=1的醋酸加水稀释,溶液中各离子浓度都减小 | |
| C. | 合成氨反应等温压缩,重新建立平衡时各组分浓度都增大 | |
| D. | pH均为2的盐酸和醋酸分别加水稀释至原来的10倍,水的电离程度相等 |


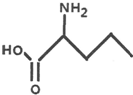 2-氨基戊酸
2-氨基戊酸 含有苯环结构的酯类化合物的同分异构体有6种,它们是:
含有苯环结构的酯类化合物的同分异构体有6种,它们是: 、
、 、
、
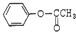 、
、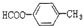 、
、 .
.