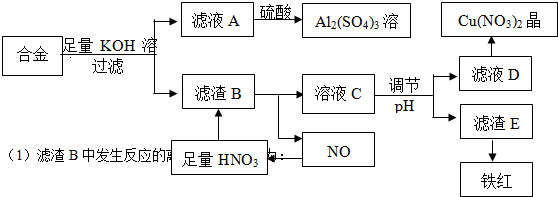
题目内容
9.NA为阿伏加德罗常数,下列说法正确的是( )| A. | 标准状况下,11.2 L的苯所含的分子个数为0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含原子个数为2.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子个数为3NA |
分析 A.苯标准状况下是液体;
B.求出乙烯的物质的量n=$\frac{m}{M}$,然后根据1mol乙烯含6mol共用电子对来分析;
C.标况下,二氯甲烷为液态;
D.根据乙烯、丙烯和丁烯的最简式均为CH2来计算.
解答 解:A.苯标准状况下是液体,故无法计算物质的量,故A错误;
B.28g乙烯的物质的量n=$\frac{m}{M}$=$\frac{28g}{28g/mol}$=1mol,而1mol乙烯含6mol共用电子对,故B错误;
C.标况下,二氯甲烷为液态,故无法计算物质的量,故C错误;
D.乙烯、丙烯和丁烯的最简式均为CH2,故14g混合物中含有的CH2的物质的量n=$\frac{14g}{14g/mol}$=1mol,含有的原子的物质的量为3mol,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
20.已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
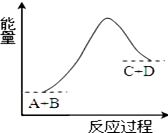

| A. | 该反应只有在加热条件下才能进行 | |
| B. | 该反应中D的能量可能大于反应物A和B的能量之和 | |
| C. | 该反应为放热反应 | |
| D. | 反应物的总能量高于生成物的总能量 |
18.下列有机分子中,所有的原子不可能处于同一平面的是( )
| A. | CH3-CH2-C≡CH | B. | CH2=CH-CH=CH2 | C. |  | D. |  |
19.某气态烃0.2mol最多和0.4mol氢气发生加成反应,所得产物又能与2mol氯气发生取代反应,最后得到一种只含碳、氯元素的化合物,则原气态烃为( )
| A. | 1-丁炔 | B. | 丙烯 | C. | 丙炔 | D. | 2-戊炔 |
 乙二醛电解氧化制备乙醛酸(OHC-COOH)的生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.
乙二醛电解氧化制备乙醛酸(OHC-COOH)的生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.
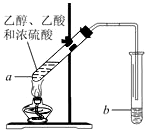 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热.
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;