题目内容
7. X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,
X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,Y、Z同周期且相邻,第一电离能:Y>Z,Z、R同主族,M核外电子有29种运动状态,
请回答下列问题:
(1)化合物XCl3的中心原子杂化类型为sp2;RCl2 的立体构型为V;
(2)H2Z、H2R的沸点分别为100℃、-60.4℃,试解释其原因H2O分子间可以形成氢键,H2S分子间不能形成氢键;
(3)H2RO3的K1和K2分别为1.54×10-2和1.02×10-7,请根据结构与性质的关系解释K1>K2的原因SO32-与H+间的结合能力强于HSO3-与H+间的结合能力,故H2SO3比HSO3-更易电离出离子,电离程度大,对应K值大;
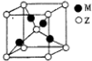
(4)Z、M形成的一种化合物晶胞如图所示:
①该化合物的化学式为Cu2O;
②若晶胞参数为apm.列式计算该晶胞的密度ρ=$\frac{288}{{a}^{3}{N}_{A}×1{0}^{-30}}$g•cm-3.
分析 X、Y、Z、R、M是原子序数依次增大五种元素,M核外电子有29种运动状态,则M为Cu;基态X原子的s电子数比p电子数多3个,原子核外电子排布式为1s22s22p1,则X为B元素;在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,则Y处于Ⅱ族或ⅤA族,结合原子序数可知,若Y处于ⅡA族,R的原子序数大于Cu,不符合题意,故Y为N元素、Z为O元素、R为S元素;
(1)化合物BCl3中B原子孤电子对数=$\frac{3-1×3}{2}$=0,价层电子对数=3+0=3,SCl2分子中S原子价层电子对个数是4且含有2个孤电子对,根据价层电子对理论判断原子杂化及微粒空间构型判断;
(2)H2O分子间可以形成氢键,H2S分子间不能形成氢键;
(3)SO32-与H+间的结合能力强于HSO3-与H+间的结合能力;
(4)①Cu与O形成的化合物为Cu2O、CuO,根据均摊法计算晶胞中黑色球、白色球数目,进而确定化学式;
②结合分子中含有原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:X、Y、Z、R、M是原子序数依次增大五种元素,M核外电子有29种运动状态,则M为Cu;基态X原子的s电子数比p电子数多3个,原子核外电子排布式为1s22s22p1,则X为B元素;在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,则Y处于Ⅱ族或ⅤA族,结合原子序数可知,若Y处于ⅡA族,R的原子序数大于Cu,不符合题意,故Y为N元素、Z为O元素、R为S元素;
(1)化合物BCl3中B原子孤电子对数=$\frac{3-1×3}{2}$=0,价层电子对数=3+0=3,其B原子杂化方式为sp2;SCl2分子中S原子价层电子对个数是4且含有2个孤电子对,所以该分子空间构型是V形,故答案为:sp2;V;
(2)H2O分子间可以形成氢键,H2S分子间不能形成氢键,氢键导致物质的熔沸点升高,所以水的熔沸点高于硫化氢,故答案为:H2O分子间可以形成氢键,H2S分子间不能形成氢键;
(3)SO32-与H+间的结合能力强于HSO3-与H+间的结合能力,导致亚硫酸比亚硫酸氢根离子更易电离出氢离子,电离程度大,对应的K值大,
故答案为:SO32-与H+间的结合能力强于HSO3-与H+间的结合能力,故H2SO3比HSO3-更易电离出离子,电离程度大,对应K值大;
(4)①Cu与O形成的化合物为Cu2O、CuO,黑色球个数为4、白色球个数=1+8×$\frac{1}{8}$=2,则黑色球与白色球个数之比为2:1,所以其化学式为Cu2O,
故答案为:Cu2O;
②ρ=$\frac{m}{V}$=$\frac{\frac{144}{{N}_{A}}×2}{(a×1{0}^{-10})^{3}}$g•cm-3=$\frac{288}{{a}^{3}{N}_{A}×1{0}^{-30}}$g•cm-3,故答案为:$\frac{288}{{a}^{3}{N}_{A}×1{0}^{-30}}$.
点评 本题考查物质结构和性质的相互关系及应用,为高频考点,涉及晶胞计算、原子杂化方式判断、氢键对物质性质的影响、微粒空间构型判断等知识点,侧重考查学生分析判断及计算能力,明确价层电子对互斥理论、均摊分是解本题关键,难点是晶胞计算,题目难度中等.

 名师点拨卷系列答案
名师点拨卷系列答案| A. | CH3Cl  | B. | 羟基 | C. | CO2  | D. | C2H4  |
| A. | 浓硫酸加入蔗糖固体中 | B. | SO2使品红溶液褪色 | ||
| C. | 四氯化碳萃取碘水中的碘 | D. | 氨气溶于水,水溶液呈碱性 |
| A. | 1.6g臭氧中含有的氧原子数为0.1NA | |
| B. | 18gD2O中含有的质子数为10NA | |
| C. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 标准状况下,11.2L己烷含有的分子数为0.5NA |

| A. | 水分子间存在π键 | B. | 水分子间存在氢键 | ||
| C. | 水分子是V形结构 | D. | 水分子是极性分子 |
| A. | 在2 min内的反应速率用B表示为0.3 mol/(L•min) | |
| B. | 在2 min内用A表示反应速率是0.4 mol/(L•min) | |
| C. | 在2 min内用C表示反应速率是0.2 mol/(L•min) | |
| D. | 当V正(B)=3V逆(D)时,反应达到平衡 |
| A. | NH4NO3 | B. | SiO2 | C. | C6H5NO2 | D. | Cu |
①4Au+8NaCN+O2+2H2O═4Na[Au(CN)2]+4NaOH
②2Na[Au(CN)2]+Zn═2Au+Na2[Zn(CN)4]
以下有关氰化法提炼金的说法中正确的是( )
| A. | Na[Au(CN)2]不溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合价为+1 | |
| C. | 金元素在地壳中能以化合态的形式存在 | |
| D. | 在提炼过程中NaCN作氧化剂 |
| … | ① | ② | ③ | |
| … | ④ | ⑤ |
(2)科学家通过对①~⑤元素的化合物进行研究,从而寻找a(选填序号).
a.高效农药 b.催化剂
c.耐高温、耐腐蚀的合金材料 d.半导体材料
(3)研究①~⑤元素的气态氢化物(用化学符号回答):②的气态氢化物的电子式
 .
.(4)④和⑤的元素最高价氧化物对应水化物的酸性较强的物质的化学式H2SO4.