题目内容
19.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:(1)有机物M经过太阳光光照可转化成N,转化过程如图:
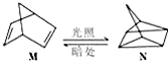 △H=+88.6kJ/mol
△H=+88.6kJ/mol则M与N相比,较稳定的是M.
(2)高温时,用CO还原MgSO4可制备高纯MgO.
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是2MgSO4+CO=2MgO+SO2+CO2+SO3.
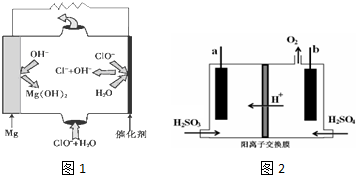
②由Mg可制成“镁-次氯酸盐”燃料电池,其装置示意图如图1,则Mg是该电池的负极,该电池反应的离子方程式为Mg+ClO-+H2O=Cl-+Mg(OH)2.
③用惰性电极电解SO2水溶液:H2SO3$\frac{\underline{\;通电\;}}{\;}$O2↑+S↓+H2O装置如图2所示,S单质将在a极得到(填“a”或“b”);该电极的电极反应式4e-+H2O+H2SO3=S↓+4OH-
分析 (1)M转化为N是吸热反应,所以N的能量高,不稳定;
(2)①根据题目信息写出生成物,根据质量守恒配平;
②由图可知镁-次氯酸盐”燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2;
③依据电池反应阳极上是氢氧根离子失电子生成氧气的反应,b为阳极,a为阴极,亚硫酸在阴极被还原为硫单质;用总反应方程式减去阳极反应式可得阴极反应式.
解答 解:(1)有机物M经过太阳光光照可转化成N,:△H=+88.6kJ•mol-1,过程是吸热反应,N暗处转化为M,是放热反应,能量越低越稳定,说明M稳定;
故答案为:M;
(2)①用CO还原MgSO4可得到MgO、CO2、SO2和SO3,方程式为2MgSO4+CO=2MgO+SO2+CO2+SO3,
故答案为:2MgSO4+CO=2MgO+SO2+CO2+SO3;
②由图可知镁-次氯酸盐”燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2,该电池反应的总反应方程式为Mg+ClO-+H2O=Cl-+Mg(OH)2,正极电极反应是ClO-离子得到电子发生还原反应,电极反应为:ClO-+2e-+H2O=Cl-+2OH-,负极电极反应是Mg失去电子发生氧化反应,电极反应为:Mg-2e-+2OH-=Mg(OH)2,
故答案为:负;Mg+ClO-+H2O=Cl-+Mg(OH)2;
③依据电池反应阳极上是氢氧根离子失电子生成氧气的反应,电极反应式为:4OH--4e-=2H2O+O2↑b为阳极,a为阴极,亚硫酸在阴极被还原为硫单质;用总反应方程式减去阳极反应式可得阴极反应式为:4e-+H2O+H2SO3=S↓+4OH-,
故答案为:a;4e-+H2O+H2SO3=S↓+4OH-.
点评 本题考查的知识点较多,既考查了电化学又考查了反应热的问题,对学生综合运用知识能力有一定的要求,特别是根据图中信息写电极反应,要求学生有较好从图中获取信息的能力,整个题目难度较大.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为:  |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
| D | ①相对分子质量比C少2; ②能由C氧化而成; |
| E | ①由C、H、O三种元素组成; ②球棍模型为: 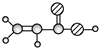 |
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式nCH2=CH2→
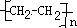 .
.(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与KMnO4酸性溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(4)C与E反应生成相对分子质量为100的酯,该反应类型为酯化反应或取代反应;其化学反应方程式为CH3CH2OH+CH2=CHCOOH$?_{△}^{浓硫酸}$CH2=CHCOOCH2CH3+H2O.
(5)写出由C氧化生成D的化学反应方程式:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
| A. | 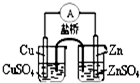 能组成Zn、Cu原电池 | B. |  能证明非金属性C>Si | ||
| C. | 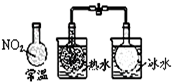 说明反应2NO2?N2O4△H>0 | D. | 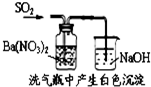 白色沉淀为BaSO4 |
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 在化合物Na2O2中,阴、阳离子的个数比为1:1 | |
| C. | 在化合物CaCl2中,两个氯离子之间存在共价键 | |
| D. | 液态HCl不能导电,属于共价化合物 |
| A. | 加入催化剂,平衡常数不变 | |
| B. | 减小容器体积,正反应速率增大、逆反应速率减小 | |
| C. | 增大CO(NH2)2的量,CO2的转化率减小 | |
| D. | 降低温度,平衡向逆反应方向移动 |
| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | 锂所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3 | |
| D. | 与水或者酸反应的剧烈程度:K>Na>Mg |