题目内容
9.下列说法错误的是( )| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | 锂所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3 | |
| D. | 与水或者酸反应的剧烈程度:K>Na>Mg |
分析 A.元素的非金属性越强,其氢化物越稳定,与原子半径大小无关;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
D.金属的金属性越强,其单质与水或酸反应越剧烈.
解答 解:A.元素的非金属性越强,其氢化物越稳定,与原子半径大小无关,非金属性Br>I,所以氢化物的稳定性HBr>HI,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性P>Si,所以H3PO4比H2SiO3的酸性强,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,第二周期中除了O、F元素外非金属性最强的是N元素,所以酸性最强的是HNO3,故C正确;
D.金属的金属性越强,其单质与水或酸反应越剧烈,金属性K>Na>Mg,所以与水或者酸反应的剧烈程度:K>Na>Mg,故D正确;
故选A.
点评 本题考查元素周期律,为高频考点,明确金属性、非金属性强弱与其最高氧化物水溶液酸碱性关系是解本题关键,注意规律中的反常现象,易错选项是C.

练习册系列答案
相关题目
20.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,1.12L CCl4中含有C-Cl键数目为0.2NA | |
| B. | 标准状况下,2.24L氯气中含有${\;}_{17}^{35}$Cl数目一定为0.2NA | |
| C. | 常温常压下,4.4g CO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 80 mL 10 mol•L-1 盐酸与足量MnO2加热反应,产生Cl2的体积为4.48L |
17.决定化学反应速率的主要因素是( )
| A. | 反应物本身的性质 | B. | 催化剂 | ||
| C. | 温度 | D. | 压强 |
4.对于可逆反应M+N?Q达到平衡时,下列说法正确的是( )
| A. | M、N、Q三种物质的浓度一定相等 | B. | 反应已经停止 | ||
| C. | 各组分的浓度保持不变 | D. | M、N全部变成了Q |
1.如表列出了A~M13种元素在周期表中的位置:
(1)这些元素中,金属性最强的元素是钾(填元素名称),非金属性最强的元素是氟(填元素名称),最不活泼的元素是Ar(填元素符号),原子半径最小的元素是H(填元素符号).
(2)写出C元素的气态氢化物与I元素的最高价氧化物的水化物反应的化学方程式:2NH3+H2SO4═(NH4)2SO4.
(3)将C、D、E三种元素的氢化物按还原性增强的顺序排列为HF<H2O<NH3(用化学式表示).
(4)A与D形成的化合物A2D2是共价化合物(填“共价”或“离子”),其电子式为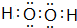 .该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑.
.该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
(2)写出C元素的气态氢化物与I元素的最高价氧化物的水化物反应的化学方程式:2NH3+H2SO4═(NH4)2SO4.
(3)将C、D、E三种元素的氢化物按还原性增强的顺序排列为HF<H2O<NH3(用化学式表示).
(4)A与D形成的化合物A2D2是共价化合物(填“共价”或“离子”),其电子式为
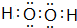 .该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑.
.该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑.
18.下列说法正确的是( )
| A. | 除去甲烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶 | |
| B. | 苯的二氯代物有3种,说明苯分子是由6个碳原子以单双键交替结合而成的六元环结构 | |
| C. | 乙酸和乙醇在浓硫酸作用下可以反应,该反应属于加成反应 | |
| D. | 乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应 |
19.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 酸性:H2SO4>H3PO4 | B. | 非金属性:Cl>Br | ||
| C. | 碱性:热稳定性:Na2CO3>NaHCO3 | D. | NaOH>Mg(OH)2 |
 △H=+88.6kJ/mol
△H=+88.6kJ/mol
 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.