题目内容
8.反应CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g)△H<0,达到平衡时,下列说法正确的是( )| A. | 加入催化剂,平衡常数不变 | |
| B. | 减小容器体积,正反应速率增大、逆反应速率减小 | |
| C. | 增大CO(NH2)2的量,CO2的转化率减小 | |
| D. | 降低温度,平衡向逆反应方向移动 |
分析 A.催化剂改变化学反应速率,不改变化学平衡;
B.减小容器体积相当于增大压强,反应速率增大;
C.固体对化学平衡无影响;
D.反应是放热反应,降低温度,平衡正向进行.
解答 解:A.催化剂改变化学反应速率,不改变化学平衡,加入催化剂,平衡常数不变,故A正确;
B.减小容器体积相当于增大压强,反应速率增大,正逆反应速率都增大,故B错误;
C.固体对化学平衡无影响,增大CO(NH2)2的量,CO2的转化率不变,故C错误;
D.依据化学平衡移动原理分析,反应是放热反应,降低温度,平衡正向进行,故D错误;
故选A.
点评 本题考查了化学平衡影响因素分析判断,平衡移动原理的理解应用,注意反应特征的方向,掌握基础是关键,题目较简单.

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
13.已知:
①1mol H2分子中化学键断裂时需要吸收436KJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
对于反应:H2(g)+Cl2(g)═2HCl(g),下列叙述正确的是( )
①1mol H2分子中化学键断裂时需要吸收436KJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
对于反应:H2(g)+Cl2(g)═2HCl(g),下列叙述正确的是( )
| A. | 反应生成2mol氯化氢气体,吸收248KJ的能量 | |
| B. | 反应生成2mol氯化氢气体,放出183KJ的能量 | |
| C. | 反应物的总能量低于生成物的总能量 | |
| D. | 该反应为吸热反应 |
20.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,1.12L CCl4中含有C-Cl键数目为0.2NA | |
| B. | 标准状况下,2.24L氯气中含有${\;}_{17}^{35}$Cl数目一定为0.2NA | |
| C. | 常温常压下,4.4g CO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 80 mL 10 mol•L-1 盐酸与足量MnO2加热反应,产生Cl2的体积为4.48L |
17.决定化学反应速率的主要因素是( )
| A. | 反应物本身的性质 | B. | 催化剂 | ||
| C. | 温度 | D. | 压强 |
18.下列说法正确的是( )
| A. | 除去甲烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶 | |
| B. | 苯的二氯代物有3种,说明苯分子是由6个碳原子以单双键交替结合而成的六元环结构 | |
| C. | 乙酸和乙醇在浓硫酸作用下可以反应,该反应属于加成反应 | |
| D. | 乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应 |
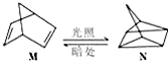 △H=+88.6kJ/mol
△H=+88.6kJ/mol
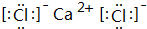 ;
; .
.