题目内容
10.如表是A、B、C、D、E五种有机物的有关信息:| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为: 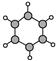 |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
| D | ①相对分子质量比C少2; ②能由C氧化而成; |
| E | ①由C、H、O三种元素组成; ②球棍模型为: 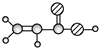 |
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式nCH2=CH2→
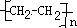 .
.(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与KMnO4酸性溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(4)C与E反应生成相对分子质量为100的酯,该反应类型为酯化反应或取代反应;其化学反应方程式为CH3CH2OH+CH2=CHCOOH$?_{△}^{浓硫酸}$CH2=CHCOOCH2CH3+H2O.
(5)写出由C氧化生成D的化学反应方程式:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
分析 由上述信息可知,A为CH2=CH2,B为苯,C为CH3CH2OH,D为CH3CHO,E为CH2=CHCOOH,
(1)乙烯与溴水发生加成反应,乙烯发生加聚反应生成聚乙烯;
(2)乙烯与氢气加成生成乙烷,烷烃中从丁烷开始出现同分异构体;
(3)结合苯的性质来解答;
(4)C与E反应发生酯化反应;
(5)乙醇催化氧化生成乙醛.
解答 解:由上述信息可知,A为CH2=CH2,B为苯,C为CH3CH2OH,D为CH3CHO,E为CH2=CHCOOH,
(1)乙烯与溴水发生加成反应生成1,2-二溴乙烷,乙烯发生加聚反应生成聚乙烯,该反应为nCH2=CH2→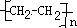 ,
,
故答案为:1,2-二溴乙烷;nCH2=CH2→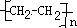 ;
;
(2)乙烯与氢气加成生成乙烷,烷烃中从丁烷开始出现同分异构体,丁烷中n=4,故答案为:4;
(3)苯的性质为①无色芳香气味液体、②有毒、③不溶于水,在一定条件下与氢气发生加成反应,不与高锰酸钾、溴水反应,易发生取代反应,苯的硝化反应为 ,故答案为:②③;
,故答案为:②③; ;
;
(4)C与E反应发生酯化反应,该反应为CH3CH2OH+CH2=CHCOOH$?_{△}^{浓硫酸}$CH2=CHCOOCH2CH3+H2O,
故答案为:酯化反应;CH3CH2OH+CH2=CHCOOH$?_{△}^{浓硫酸}$CH2=CHCOOCH2CH3+H2O;
(5)乙醇催化氧化生成乙醛,该反应为2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
点评 本题考查有机物的结构与性质,注意把握有机物中的官能团与性质的关系,熟悉常见有机物的性质即可解答,总结归纳常见有机反应类型及特点,题目难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
19.某合金由铜、镁两种金属组成,现取合金5.0g于烧杯中,将100g稀盐酸分两次加人到烧杯中,所得数据如下表.
请计算:
(1)合金中镁的质量为4g;
(2)所用稀盐酸的溶质质量分数.
| 次数 | 第1次 | 第2次 |
| 加入稀盐酸的质量/g | 50 | 50 |
| 剩余固体的质量/g | 2.6 | 1 |
(1)合金中镁的质量为4g;
(2)所用稀盐酸的溶质质量分数.
1.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )


| A. | 反应CH4+H2O $\frac{\underline{催化剂}}{△}$3H2+CO,每消耗1 mol CH4转移12 mol电子 | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- |
5.原子的电子排布为[Ar]3d54s2的元素位于( )
| A. | s区 | B. | p区 | C. | d区 | D. | f区 |
15.下列叙述正确的是( )
①热稳定性:H2O>HF>H2S
②泥水、淀粉溶液、盐酸分别属于悬浊液、胶体、溶液
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤第IA族元素铯的两种同位素137Cs比133Cs多4个质子
⑥已知2H2(g)+O2(g)=2H2O(l)△H=-571kJ•mol-1则氢气的燃烧热为△H=-285.5kJ•mol-1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
①热稳定性:H2O>HF>H2S
②泥水、淀粉溶液、盐酸分别属于悬浊液、胶体、溶液
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤第IA族元素铯的两种同位素137Cs比133Cs多4个质子
⑥已知2H2(g)+O2(g)=2H2O(l)△H=-571kJ•mol-1则氢气的燃烧热为△H=-285.5kJ•mol-1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
| A. | 只有②④⑥ | B. | 只有①⑤⑥ | C. | 只有②③④ | D. | 只有③⑤⑦ |
2.分子式为C10H14的一取代芳香烃,其可能的结构有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
20.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,1.12L CCl4中含有C-Cl键数目为0.2NA | |
| B. | 标准状况下,2.24L氯气中含有${\;}_{17}^{35}$Cl数目一定为0.2NA | |
| C. | 常温常压下,4.4g CO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 80 mL 10 mol•L-1 盐酸与足量MnO2加热反应,产生Cl2的体积为4.48L |
 △H=+88.6kJ/mol
△H=+88.6kJ/mol