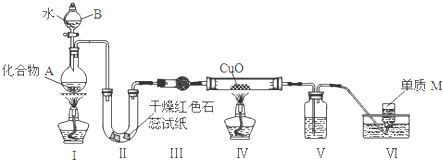
题目内容
11.已知:某原电池的总反应为:2Fe3++Cu═2Fe2++Cu2+.则:①该原电池的正极材料可以选用(填材料名称):不如Cu活泼的金属或石墨电极,该电极的电极反应式是:2Fe3++2e-=2Fe2+,
②若负极质量减少1.28克,那么电路中转移的电子数为:0.04NA.
分析 原电池的总反应为:2Fe3++Cu═2Fe2++Cu2+,Cu作负极,失电子发生氧化反应,正极材料是不如Cu活泼的金属或石墨电极,Fe3+在正极上得电子发生还原反应,据负极的电极反应式计算有1.28gCu反应时,转移电子的数目.
解答 解:①正极材料是不如Cu活泼的金属或石墨电极,Fe3+在正极上得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+;
故答案为:不如Cu活泼的金属或石墨电极;2Fe3++2e-=2Fe2+;
②Cu-2e-=Cu2+;
64g 2mol
1.28g n
n=$\frac{1.28g×2mol}{64g/mol}$=0.04mol,转移电子个数为0.04NA,
故答案为:0.04NA.
点评 本题考查了据氧化还原反应方程式设计原电池以及据电极反应式的计算,题目难度不大,注意把握原电池中正负极的判断和电极方程式的书写方法.

练习册系列答案
相关题目
1.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )


| A. | 反应CH4+H2O $\frac{\underline{催化剂}}{△}$3H2+CO,每消耗1 mol CH4转移12 mol电子 | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- |
2.分子式为C10H14的一取代芳香烃,其可能的结构有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
6.有以下四种微粒14N、15N、N2、N4(结构为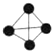 ),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
 ),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A. | 14N2与15N2互为同位素,N4与N2互为同素异形体 | |
| B. | N4属于一种新型的化合物 | |
| C. | 14N与15N化学性质不相同 | |
| D. | 1mol N4气体完全转变为N2将放出882kJ热量 |
20.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,1.12L CCl4中含有C-Cl键数目为0.2NA | |
| B. | 标准状况下,2.24L氯气中含有${\;}_{17}^{35}$Cl数目一定为0.2NA | |
| C. | 常温常压下,4.4g CO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 80 mL 10 mol•L-1 盐酸与足量MnO2加热反应,产生Cl2的体积为4.48L |
1.如表列出了A~M13种元素在周期表中的位置:
(1)这些元素中,金属性最强的元素是钾(填元素名称),非金属性最强的元素是氟(填元素名称),最不活泼的元素是Ar(填元素符号),原子半径最小的元素是H(填元素符号).
(2)写出C元素的气态氢化物与I元素的最高价氧化物的水化物反应的化学方程式:2NH3+H2SO4═(NH4)2SO4.
(3)将C、D、E三种元素的氢化物按还原性增强的顺序排列为HF<H2O<NH3(用化学式表示).
(4)A与D形成的化合物A2D2是共价化合物(填“共价”或“离子”),其电子式为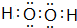 .该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑.
.该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
(2)写出C元素的气态氢化物与I元素的最高价氧化物的水化物反应的化学方程式:2NH3+H2SO4═(NH4)2SO4.
(3)将C、D、E三种元素的氢化物按还原性增强的顺序排列为HF<H2O<NH3(用化学式表示).
(4)A与D形成的化合物A2D2是共价化合物(填“共价”或“离子”),其电子式为
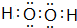 .该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑.
.该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑. 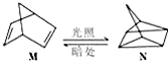 △H=+88.6kJ/mol
△H=+88.6kJ/mol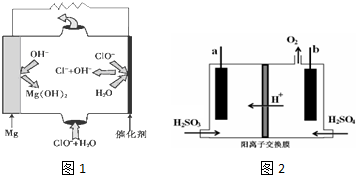
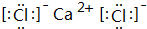 ;
; .
.