题目内容
14.下列实验对应的结论不正确的是( )| A. | 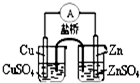 能组成Zn、Cu原电池 | B. |  能证明非金属性C>Si | ||
| C. | 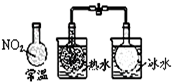 说明反应2NO2?N2O4△H>0 | D. | 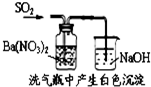 白色沉淀为BaSO4 |
分析 A.左侧发生还原反应,右侧发生氧化反应,由两个半反应构成原电池反应;
B.盐酸易挥发,盐酸可与硅酸钠溶液反应;
C.热水中颜色深,升高温度反应2NO2?N2O4正向移动;
D.二氧化硫与硝酸钡发生氧化还原反应生成硫酸钡沉淀.
解答 解:A.左侧发生还原反应,右侧发生氧化反应,由两个半反应构成原电池反应,能组成Zn、Cu原电池,Cu为正极,Zn为负极,故A正确;
B.盐酸易挥发,盐酸可与硅酸钠溶液反应,不能比较碳酸、硅酸的酸性,则不能比较C、Si的非金属性,故B错误;
C.热水中颜色深,升高温度反应2NO2?N2O4正向移动,可知2NO2?N2O4△H>0,故C正确;
D.二氧化硫与硝酸钡发生氧化还原反应生成硫酸钡沉淀,白色沉淀为BaSO4,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,侧重于学生的分析能力、实验能力的考查,把握相关反应原理、实验技能、实验装置的作用为解答的关键,题目难度不大.

练习册系列答案
相关题目
5.原子的电子排布为[Ar]3d54s2的元素位于( )
| A. | s区 | B. | p区 | C. | d区 | D. | f区 |
2.分子式为C10H14的一取代芳香烃,其可能的结构有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
6.有以下四种微粒14N、15N、N2、N4(结构为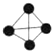 ),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
 ),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A. | 14N2与15N2互为同位素,N4与N2互为同素异形体 | |
| B. | N4属于一种新型的化合物 | |
| C. | 14N与15N化学性质不相同 | |
| D. | 1mol N4气体完全转变为N2将放出882kJ热量 |
4.对于可逆反应M+N?Q达到平衡时,下列说法正确的是( )
| A. | M、N、Q三种物质的浓度一定相等 | B. | 反应已经停止 | ||
| C. | 各组分的浓度保持不变 | D. | M、N全部变成了Q |
 和
和 (写结构简式)
(写结构简式)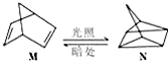 △H=+88.6kJ/mol
△H=+88.6kJ/mol