题目内容
5.如表是元素周期表的一部分,表中所列的字母分别代表某一化学元素| a | ||||||||||||||||||
| g | j | |||||||||||||||||
| b | c | f | i | l | m | |||||||||||||
| e | h | k | ||||||||||||||||
(2)下列AC组元素的单质可能都是电的良导体.
A.d、e、f B.b、c、i C.c、d、g D.a、g、k
(3)表中某元素的最高价氧化物对应水化物呈两性的化学式是Al(OH)3,
它与短周期元素b的最高价氧化物对应水化物发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(4)b、a与j形成原子个数比为1:1:1的化合物中含有的化学键类型是离子键和共价键.
分析 由元素在周期表的位置可知,a为H,b为Na,c为Mg,e为Fe,h为Ge,k为Se,f为Al,g为C,i为P,j为O,l为Cl,m为Ar,
(1)据元素周期表的结构七主七副零八族分析;根据化学元素汉字名称的偏旁可辨别元素的种类;e为Fe元素,根据元素的质子数可知电子数为26,核外各电子层电子数为2、8、14、2,所以位于第四周期第VIII族;
(2)金属元素单质及石墨是电的良导体;
(3)氢氧化铝能与强酸、强碱反应生成盐与水;b的最高价氧化物对应水化物为氢氧化钠,与氢氧化铝反应生成偏铝酸钠和水;
(4)b、a与j形成原子个数比为1:1:1形成的化合物是NaOH,一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物为离子化合物,离子化合物中可能含有共价键,只含共价键的化合物为共价键化合物,据此进行分析.
解答 解:(1)元素周期表的结构为七主七副零八族,故属于主族元素的有a、b、c、d、f、g、h、i、j、k、l,根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,故金属元素有 b、c、d、e、f、h;e为Fe元素,根据元素的质子数可知电子数为26,核外各电子层电子数为2、8、14、2,所以位于第四周期第VIII族;
故答案为:a、b、c、d、f、g、h、i、j、k、l; b、c、d、e、f、h;第四周期 VIII族;
(2)金属元素单质以及石墨是电的良导体,选项中只有AC符合,故选AC,
故答案为:AC;
(3)氢氧化铝能与强酸、强碱反应生成盐与水,氢氧化铝是两性氢氧化物;b的最高价氧化物对应水化物为氢氧化钠,与氢氧化铝反应生成偏铝酸钠和水反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(4)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物为离子化合物,离子化合物中可能含有共价键,只含共价键的化合物为共价键化合物,b、a与j形成原子个数比为1:1:1形成的化合物是NaOH,氢氧化钠中钠离子和氢氧根离子之间存在离子键,氢原子和氧原子之间存在共价键,
故答案为:离子键和共价键.
点评 本题考查元素周期表及其应用,需要学生熟练注意元素周期表,有利于基础知识的巩固.

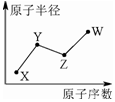 X、Y、Z、W是四种常见的短周期主族元素,其单质都是双原子气体分子.它们原子半径随原子序数的变化如下图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其单质都是双原子气体分子.它们原子半径随原子序数的变化如下图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W处于同一周期 | |
| B. | Y、W的最简单氢化物的水溶液能相互反应生成离子化合物 | |
| C. | 非金属性:Y>Z | |
| D. | X、Z、W形成的化合物均为强酸 |
(2)写出下列基态原子的简化电子排布式:
①14Si1s22s22p63s23p2 或[Ne]3s23p2;②26Fe1s22s22p63s23p63d64s2或[Ar]3d64s2 .
(3)按所示格式填写表中的空格:
| 原子序数 | 原子的价电子排布式 | 周期 | 族 |
| 17 | 第三 | ||
| 3d54s1 | ⅥB |
(5)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是Fe3+,配离子[Cu(NH3)4]2+的配体是NH3.
(6)根据价层电子对互斥理论判断:
①NH3分子中,中心原子上的σ键电子对数为3,孤电子对数为1,价层电子对数为4,中心原子的杂化方式为sp3杂化,VSEPR构型为四面体形,分子的立体构型为三角锥形.
②BF3分子中,中心原子的杂化方式为sp2杂化,分子的立体构型为平面(正)三角形.
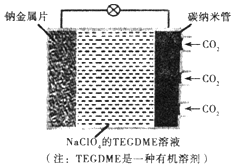 我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )
我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )| A. | 充电时,Na+从阳极向阴极移动 | |
| B. | 可以用乙醇代替TEGDME做有机溶剂 | |
| C. | 放电时,当转移lmol电子负极质量减轻23g | |
| D. | 放电时,正极反应为3CO2+4Na++4e-=2Na2CO3+C |
| A. | 加入过量NaOH溶液:Na+、AlO2-、OH-、SO42- | |
| B. | 加入过量氨水:NH4+、Al3+、OH-、SO42- | |
| C. | 通入过量Cl2:Fe2+、Na+、Cl-、SO42- | |
| D. | 通入过量SO2:Fe2+、H+、SO32-、SO42- |
