题目内容
10.(1)在同一个原子中,离核越近、n越小的能层中的电子能量越低.理论研究证明,多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级,分别为3s、3p和3d.现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做基态原子.(2)写出下列基态原子的简化电子排布式:
①14Si1s22s22p63s23p2 或[Ne]3s23p2;②26Fe1s22s22p63s23p63d64s2或[Ar]3d64s2 .
(3)按所示格式填写表中的空格:
| 原子序数 | 原子的价电子排布式 | 周期 | 族 |
| 17 | 第三 | ||
| 3d54s1 | ⅥB |
(5)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是Fe3+,配离子[Cu(NH3)4]2+的配体是NH3.
(6)根据价层电子对互斥理论判断:
①NH3分子中,中心原子上的σ键电子对数为3,孤电子对数为1,价层电子对数为4,中心原子的杂化方式为sp3杂化,VSEPR构型为四面体形,分子的立体构型为三角锥形.
②BF3分子中,中心原子的杂化方式为sp2杂化,分子的立体构型为平面(正)三角形.
分析 (1)离核较近的电子层有较低的能量,随着电子层数的增加,电子层的能量越来越大;原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做基态原子;
(2)根据元素原子的核外电子数,结合能量最低原理书写核外电子排布式
①14Si为14号元素,原子核外14个电子,有三个电子层;
②26Fe元素为26号元素,原子核外有26个电子,有四个电子层;
(3)根据元素原子原子序数等于核外电子数,结合能量最低原理书写核外电子排布式,周期数等于原子核外电子层数,族等于最外层电子数;
(4)N≡N中含有2个π键,1个σ键,已知N≡N键能为942kJ/mol,N-N单键键能为247kJ/mol,则1个π键的键能为$\frac{942-247}{2}$kJ/mol=347.5kJ/mol,以此判断;
(5)配合物中中心原子提供空轨道,配体提供孤电子对;
(6)①价层电子对数=σ键电子对数+孤电子对数;根据价层电子对数判断VSEPR模型和分子的立体结构;
②根据价层电子对互斥理论判断中心原子杂化类型及分子空间构型,价层电子对个数=成键电子对个数+孤电子对个数.
解答 解:(1)离核较近的电子层有较低的能量,随着电子层数的增加,电子层的能量越来越大,所以在同一个原子中,离核越近、n越小的电子层能量越低;在同一电子层中,各亚层的能量按s、p、d、f的次序依次增大;原子第三能层的能级分别为s、p、d,第三能层有3个能级,分别为3s、3p和3d,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做基态原子,
故答案为:低; 3d; 基态;
(2)①14Si14号元素,原子核外14个电子,有三个电子层,核外电子排布式为:1s22s22p63s23p2 或[Ne]3s23p2,
故答案为1s22s22p63s23p2 或[Ne]3s23p2;
②26Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2,
故答案为:1s22s22p63s23p63d64s2或[Ar]3d64s2 ;
(3)原子序数17,说明原子核外电子数为17,根据构造原理、洪特规则特例得到电子排布式为1s2 2s22p6 3s23p5,价电子排布式为3s23p5,最大能层数为3,说明处于第3周期,价电子数为7个,说明处于第ⅤⅡA族,价电子排布式补齐前面的电子排布为1s2 2s22p6 3s23p63d5 4s1,原子序数=核外电子数=24,最大能层数为4,价电子数为6,位于第四周期ⅥB族,
故答案为:
| 原子序数 | 原子的价电子排布式 | 周期 | 族 |
| 17 | 3s23p5 | VIIA | |
| 24 | 第四 |
(4)N≡N中含有2个π键,1个σ键,已知N≡N键能为942kJ/mol,N-N单键键能为247kJ/mol,则1个π键的键能为$\frac{942-247}{2}$kJ/mol=347.5kJ/mol,则N2中的π键键能大于σ键键能,较稳定,
故答案为:π;
(5)在配合物离子[Fe(SCN)]2+中,中心离子是Fe3+,提供提供空轨道接受孤对电子;配离子[Cu(NH3)4]2+的配体是NH3,
故答案为:Fe3+; NH3;
(6)①价层电子对数=σ键电子对数+孤电子对数,根据NH3的电子式
 可知,中心原子N有1个孤电子对和3个σ键电子对,共4个价层电子对,中心原子的杂化方式为sp3杂化,VSEPR模型名称为四面体形,分子的立体构型为三角锥形;
可知,中心原子N有1个孤电子对和3个σ键电子对,共4个价层电子对,中心原子的杂化方式为sp3杂化,VSEPR模型名称为四面体形,分子的立体构型为三角锥形;故答案为:3;1;4;sp3;四面体形;三角锥形;
②BF3分子中B原子价层电子对个数是3且不含孤电子对,所以B原子采用sp2杂化,分子空间构型是平面正三角形;
故答案为:sp2;平面正三角形.
点评 本题考查了原子核外电子排布式、电子排布规律,σ键和π 键的判断,价层电子对数及空间构型的判断,题目综合性强,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 金属钠露置在空气中,光亮表面颜色变暗:4Na+O2═2Na2O | |
| B. | 铝条插入烧碱溶液中,开始没有明显现象:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 硫酸铵溶液与氢氧化钡溶液混合,产生气体:NH4++OH-═NH3↑十+H2O | |
| D. | 碘化银悬浊液滴加硫化钠溶液,黄色沉淀变成黑色:2AgI+S2-═Ag2S↓+2I- |
| A. | 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| B. | 室温下,测得氯化铵溶液pH<7:NH4++H2O=NH3•H2O+H+ | |
| C. | 石灰水中加入过量碳酸氢钠溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 用小苏打片治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
| a | ||||||||||||||||||
| g | j | |||||||||||||||||
| b | c | f | i | l | m | |||||||||||||
| e | h | k | ||||||||||||||||
(2)下列AC组元素的单质可能都是电的良导体.
A.d、e、f B.b、c、i C.c、d、g D.a、g、k
(3)表中某元素的最高价氧化物对应水化物呈两性的化学式是Al(OH)3,
它与短周期元素b的最高价氧化物对应水化物发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(4)b、a与j形成原子个数比为1:1:1的化合物中含有的化学键类型是离子键和共价键.
| 实验1 | 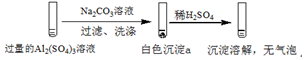 |
| 实验2 | 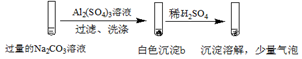 |
| A. | 实验1中,白色沉淀a是Al(OH)3 | |
| B. | 实验2中,白色沉淀b含有CO32- | |
| C. | 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关 | |
| D. | 检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液 |
| A. | 使用过量的乙酸 | B. | 采用边反应边蒸馏的方法 | ||
| C. | 反应采用水浴加热 | D. | 用氢氧化钠溶液提纯乙酸丁酯 |
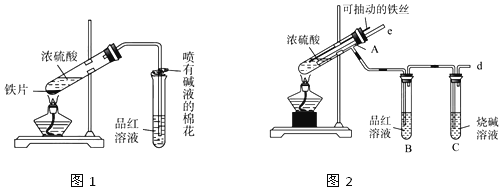
[探究一]:SO2能否被BaCl2溶液吸收.
甲.乙两同学分别设计如图装置甲和装置乙进行探究
甲、乙两同学实验时观察到各仪器中的现象如下:
| A | B | C | D | |
| 装置甲中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 白色沉淀 | ----- | ------ |
| 装置乙中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 有气泡 | 有气泡 | 品红褪色 |
(1)甲同学经过后续实验确证了B中白色沉淀是BaSO4.甲同学的后续实验操作是打开B试管的胶塞,向其中滴加稀盐酸,若白色沉淀不消失,证明白色沉淀是BaSO4

(2)乙同学分析装置甲中产生BaSO4的可能原因有:
①A中产生的白雾是硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀.
②2SO2+O2+2H2O+2Ba2+=2BaSO4+4H+(用离子方程式表示).
(3)装置乙中B中所盛试剂是饱和NaHSO3溶液;乙同学在滴加浓硫酸之前的操作是打开弹簧夹向A中通往一段时间的N2,然后关闭弹簧夹
(4)通过上述实验,得出的结论是SO2不能被BaCl2溶液吸收
[探究二]:SO2与FeCl3溶液的反应
查阅资料:①Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+;②生成Fe(HSO3)2+离子的反应为可逆反应.实验步骤为:
| 步骤I | 往5mL1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤II | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
(5)当SO2通入到FeCl3(未用盐酸酸化)溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
则溶液由棕黄色变成红棕色的原因是二氧化硫溶于水SO2+H2O?HSO3-+H+,Fe3++HSO3-?Fe(HSO3)2+;写出溶液由红棕色变为浅绿色时发生反应的离子方程式Fe3++Fe(HSO3)2++H2O=2Fe2++SO42-+3H+
(6)通过实验可知加热和增加FeCl3溶液的酸度可缩短浅绿色出现的时间.