题目内容
6.反应4NH3+5O2?4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了3mol,则此反应的平均反应速率v(H2O)为( )| A. | 0.02mol•L-1•s-1 | B. | 1.5mol•L-1•min-1 | ||
| C. | 0.03mol•L-1•s-1 | D. | 1.8mol•L-1•min-1 |
分析 根据△c=$\frac{△n}{V}$计算NO的浓度变化量,再根据v=$\frac{△c}{△t}$计算v(NO),反应速率之比等于化学方程式计量数之比计算v(H2O);
解答 解:30s后NO的物质的量增加了3mol,则△c(NO)=$\frac{3mol}{5L}$=0.6mol/L,
故v(NO)=$\frac{0.6mol/L}{30s}$=0.02mol/(L•s),V(NO)=$\frac{0.6mol/L}{0.5min}$=1.2mol/L•min,
则v(H2O)=$\frac{6}{4}$V(NO)=$\frac{6}{4}$×0.02mol/(L•s)=0.03mol•L-1•s-1,
v(H2O)=$\frac{6}{4}$V(NO)=$\frac{6}{4}$×1.2mol/L•min=1.8mol/(L•min)
故选CD.
点评 本题考查化学反应速率的计算,比较基础,注意对公式的理解与灵活运用,掌握基础是关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.从碳骨架形状进行分类,关于下列各有机物的说法中正确的是( )
①CH3CH2Cl②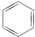 ③(CH3)2C=CH2④
③(CH3)2C=CH2④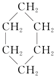 ⑤
⑤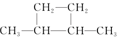
①CH3CH2Cl②
 ③(CH3)2C=CH2④
③(CH3)2C=CH2④ ⑤
⑤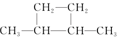
| A. | 链状烃:①③⑤ | B. | 链状烃:③⑤ | C. | 环状烃:②④⑤ | D. | 芳香烃:②④ |
17.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向FeCl2溶液中滴加氯水,溶液颜色变为棕黄色,说明氯水中含有HClO | |
| C. | 向氯水中滴加稀硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| D. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
14.下列叙述正确的是( )
| A. | 铝粉与氧化镁共热可制取金属镁 | |
| B. | 铝分别与足量的 HCl溶液、足量的NaOH的溶液反应,产生的氢气前者多 | |
| C. | 可用Na2SiO3溶液和CO2反应来制备H2SiO3 | |
| D. | NaOH溶液可以盛装在带玻璃塞的磨口试剂瓶中 |
1.某有机物分子中含n1个-CH2-,n2个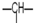 ,n3个-OH,其余为甲基.则甲基的个数为( )
,n3个-OH,其余为甲基.则甲基的个数为( )
 ,n3个-OH,其余为甲基.则甲基的个数为( )
,n3个-OH,其余为甲基.则甲基的个数为( )| A. | n1+n2+n3 | B. | 2n2+2n1-n3 | C. | n2+2-n3 | D. | 2n1+n2+2-n3 |
18.可逆反应2NO2═2NO+O2在恒容的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2
②用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1
③混合气体的颜色不再改变
④混合气体的密度不再改变
⑤混合气体的平均相对分子质量不再改变.
①单位时间内生成n molO2的同时生成2n molNO2
②用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1
③混合气体的颜色不再改变
④混合气体的密度不再改变
⑤混合气体的平均相对分子质量不再改变.
| A. | ①③⑤ | B. | ①④⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |
15.在某2L的密闭容器中,充入2molN2、8molH2,一定条件下,发生反应:N2+3H2?2NH3;经过5min达化学平衡,此时H2的物质的量是5mol.则( )
| A. | N2的消耗量是3.0mol | |
| B. | N2的平均速率是0.5mol•(L•min)-1 | |
| C. | N2的平衡浓度是1.0mol•L-1 | |
| D. | N2反应的量占原物质的量的百分数是50% |
8.亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行多角度探究:
(一)鉴别NaCl和NaNO2
甲同学用沉淀分析法
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10.分别向盛有5mL 0.0001 mol/L两种盐溶液的试合中同时逐滴滴加0.0001mol•L-1硝酸银溶液,先生成沉淀的是装有NaCl溶液的试管.
乙同学侧定溶液pH
用pH试纸分别测定0.1 mol•L-1两种盐溶液的pH,测得NaNO2溶液呈碱性.该溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).
(二)该小组用如下装置(略去夹持仪器)制备亚硝酸钠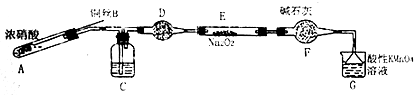
已知:①2NO+Na2O2=2NaNO2;
②酸性条件下,NO和NO2都能与MnO4一反应生成NO3一和Mn2+•
(1)使用铜丝的优点是可以控制反应的发生与停止.
(2)装置A中反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
装置C 中盛放的药品是C;(填字母代号)
A.浓硫酸 B.NaOH 溶液 C.水 D.四氯化碳
仪器F的作用防止水蒸气进入.
(3)该小组称取5.000g制取的样品溶于水配成250.0 mL溶液,取25.00mL溶液于锥形
瓶中,用0.1000mol/L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
①第一次实验数据出现异常,造成这种异常的原因可能是bc(填字母代号).
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O.
③该样品中亚硝酸钠的质量分数为69%.
(一)鉴别NaCl和NaNO2
甲同学用沉淀分析法
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10.分别向盛有5mL 0.0001 mol/L两种盐溶液的试合中同时逐滴滴加0.0001mol•L-1硝酸银溶液,先生成沉淀的是装有NaCl溶液的试管.
乙同学侧定溶液pH
用pH试纸分别测定0.1 mol•L-1两种盐溶液的pH,测得NaNO2溶液呈碱性.该溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).
(二)该小组用如下装置(略去夹持仪器)制备亚硝酸钠

已知:①2NO+Na2O2=2NaNO2;
②酸性条件下,NO和NO2都能与MnO4一反应生成NO3一和Mn2+•
(1)使用铜丝的优点是可以控制反应的发生与停止.
(2)装置A中反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
装置C 中盛放的药品是C;(填字母代号)
A.浓硫酸 B.NaOH 溶液 C.水 D.四氯化碳
仪器F的作用防止水蒸气进入.
(3)该小组称取5.000g制取的样品溶于水配成250.0 mL溶液,取25.00mL溶液于锥形
瓶中,用0.1000mol/L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.7 | 20.12 | 20.00 | 19.88 |
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O.
③该样品中亚硝酸钠的质量分数为69%.
 .
.